Методов непосредственного измерения энтропии не существует, но можно рассчитать изменение этой функции при различного рода процессах, пользуясь математическим выражением второго начала термодинамики для обратимых процессов. Так как энтропия является функцией состояния, то ее изменение при переходе системы из начального состояния в конечное будет одним и тем же независимо от того, совершается ли этот переход обратимым или необратимым путем.
1. Расчеты изменения энтропии при изотермических процессах
Примерами изотермических могут служить такие процессы, как плавление, испарение, возгонка, превращение одной полиморфной модификации в другую. При обратимом (равновесном) проведении этих процессов давление остается постоянным.
При изотермическом процессе, проводимом обратимо, изменение энтропии рассчитывается по следующей формуле:
![]() . (4.6)
. (4.6)
2. Расчет изменения энтропии в неизотермических процессах
Если процесс протекает не изотермически, то расчет изменения энтропии проводят, исходя из следующего:
![]() но
но ![]() ,
,
тогда
![]() .
.
Для конечных изменений
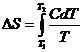
или
![]() . (4.7)
. (4.7)
Уравнение (4.7) справедливо для тех случаев, когда теплоемкость в данном температурном интервале практически не зависит от температуры.
3. Расчет изменения энтропии сложного процесса
Изменение энтропии сложного процесса, состоящего из нескольких стадий, равняется сумме изменений энтропий каждой отдельной стадии этого процесса:
![]() . (4.8)
. (4.8)
Например, изменение энтропии при обратимом превращении 10,0 г льда, находящегося при -10 °С, в пар при 120 °С, если
С(Н2О, ТВ) = 2,03 Дж г-1 К-1; DНпл. льда = 331,89 Дж г-1;
С(Н2О, Ж) = 4,18 Дж г-1 К-1; DНисп. Н2О = 2253,4 Дж г-1.
С(Н2О, Г) = 1,93 Дж г-1 К-1;
Вычисляют следующим образом.
Данный процесс представим из пяти стадий:
1. Нагревание льда от -10 °С до 0 °С, DS1.
2. Плавление льда, DS2.
3. Нагревание жидкой воды от 0°С до 100 °С, DS3.
4. Испарение воды, DS4.
5. Нагревание пара от 100 °С до 120 °С, DS5.
Изменение энтропии в 1, 3, 5 стадиях рассчитывают по уравнению
![]() .
.
В стадиях 2, 4 – по уравнению ![]() .
.
Общее изменение энтропии составит: ![]() .
.
Поможем написать любую работу на аналогичную тему

