С точки зрения термодинамики живые клетки представляют собой открытые системы. Как указывалось ранее, открытой называется система, которая обменивается свнешней средой материей и энергией. Основополагающие термодинамические уравнения, написанные для изолированных и закрытых систем, должны быть в этом случае модифицированы. В них необходимо ввести члены, отражающие изменения массы системы. В этом случае дифференцирование уравнения для термодинамических функций U, Н и G будут иметь следующий вид:
![]() (6.1)
(6.1)
![]() (6.2)
(6.2)
![]() (6.3)
(6.3)
где m – химический потенциал, n – число молей соответствующего компонента. Каждому компоненту системы в уравнении соответствует свой член mdn. Если в правой части каждого уравнения все переменные, за исключением n1, будут оставаться постоянными, то мы получим следующий ряд равенств:
![]()
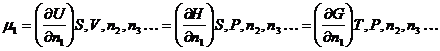
а также из уравнения (6.1)
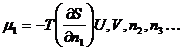
Из приведенных выше уравнений видно, что в зависимости от того, какие величины остаются постоянными, химический потенциал представляет собой парциальную молярную внутреннюю энергию, энтальпию или свободную энергию. Поскольку химические процессы в живых клетках и в большинстве экспериментальных систем in vitro протекают при постоянной температуре и при постоянном давлении, наиболее полезным является определение химического потенциала как парциальной молярной свободной энергии. При обсуждении свободной энергии Гиббса мы подчеркиваем значение этой величины как критерия равновесия в системах при постоянных Т и Р: равновесие достигается при DG = 0.
Следовательно, когда свободная энергия перестает в системе меняться, химический потенциал любого компонента системы остается постоянным.
Таким образом, условие равновесия может быть записано как DmI = 0 при Р и Т = const.
Аналогично тому, как мы определяли стандартные изменения для других термодинамических функций и получали стандартные ΔН°,ΔS° и ΔG°, мы можем определить также стандартный химический потенциал μ° как изменение свободной энергии на 1 моль вещества, образующегося, расходующегося или переходящего из одной фазы в другую в своем стандартном состоянии (т.е. при давлении в 1 атм, при определенной температуре и в стандартной эталонной форме).
Поможем написать любую работу на аналогичную тему

