П = iCRT, где i – изотонический коэффициент:
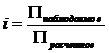 .
.
Для слабых электролитов i равно отношению фактического числа частиц растворенного вещества к тому числу, которое было бы вотсутствие диссоциации.
Расчет изотонического коэффициента: до диссоциации N частиц, a – степень диссоциации, тогда число диссоциированных частиц – aN, а недиссоциированных – (1–a)N, k – количество образующихся ионов. Тогда при диссоциации образуется aN частиц aNk – ионов. Общее число частиц равно:
![]() .
.
Отсюда изотонический коэффициент:
![]() или i = 1+a(k-1).
или i = 1+a(k-1).
Для NaCl « Na+ + Cl- k = 2 i = 1 + a;
Для Na2SO4 « 2 Na+ + SO4- k = 3 i = 1 + 2a;
Для Na3PO4 « 3Na+ + PO43- k = 4 i = 1 + 3a и т.д.
Для сильных электролитов a = 1.
Поможем написать любую работу на аналогичную тему

