«В конце концов мы должны признать, что ионная теория неполна, но в химии редко удается достичь совершенства. Наши научные теории совсем не похожи на законы, действующие, подобно сжатым пружинам, сразу же и неумолимо. Наши теории создаются медленно и постепенно, и мы должны честно признать, что ионная теория пока еще переживает пору своей юности. Вместо того, чтобы судить ее по строгим меркам совершенства, давайте просто спросим, чего она уже достигла и что она еще может дать науке», эти слова принадлежат Г. Льюису.
Теория электролитической диссоциации ныне стала одной из незыблемых основ наших научных представлений, и трудно поверить, что докторская диссертация С. Аррениуса, в которой он в 1884 году изложил эту теорию, была принята в университете города Уппсала (Швеция) с наинижайшей из возможных оценок.
В дальнейшем идеи Аррениуса встречали не столько противодействие, сколько полное пренебрежение, но, в конце концов, благодаря объединенным усилиям Я. Вант-Гоффа и В. Оствальда они завоевали всеобщее признание.
Важным вкладом в эту теорию стали последующие работы Ф.Х. Гроттуса, Н.Н. Каяндера и др.
Для обоснования гипотезы электролитической диссоциации имело значение сопоставление: 1) способности разбавленных водных растворов солей, кислот, оснований проводить электрический ток и 2) систематических отклонений некоторых свойств (температуры замерзания, температуры кипения, давления насыщенного пара, осмотического давления и др.) этих растворов и таких же свойств других разбавленных растворов. Была обнаружена количественная взаимосвязь между отклонениями в этих свойствах и способностью проводить электрический ток. Растворы, обнаруживающие большее отклонение в названных свойствах, обладают в общем и большей электропроводностью.
Гипотеза Аррениуса дала возможность объяснить многие особенности в химических свойствах растворов электролитов (реакции гидролиза, значение концентрации водородных ионов и др.). Согласно гипотезе электролитической диссоциации, молекулы солей, кислот и оснований при растворении их в воде претерпевают диссоциацию на ионы.
Однако в гипотезе Аррениуса раствор электролитов рассматривался по существу как механическая смесь из молекул растворителя и ионов и молекул электролита, т.е. в этой гипотезе не находило отражения взаимодействие между всеми этими частицами и поэтому оставалась без объяснения и основная сущность явления.
Развитию гипотезы электролитической диссоциации способствовали работы И.А. Каблукова, В. Нернста, Х. Джонса и др.
Явление электролитической диссоциации наблюдается не только в водных растворах. В других растворителях, особенно обладающих высокой диэлектрической проницаемостью (в том числе и органических), происходит электролитическая диссоциация.
В настоящее время считается, что переход ионов в раствор происходит в результате образования связей между ионом и молекулами растворителя (сольватация) и, в частном случае, молекулами воды (гидратация). Объяснить это можно тем, что в среде с высокой диэлектрической проницаемостью ослабляется сила электростатического притяжения между ионами, равная, согласно закону Кулона,
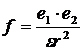 .
.
Однако этим дело не ограничивается. Если диссоциация протекает в растворителях, молекулы которых способны к образованию водородных и донорно-акцепторных связей, то этот вид взаимодействия молекул растворителя с частицами электролита может существенно влиять на ход процесса. Так, в растворителях с высокой диссоциирующей способностью (Н2О, НF) именно такое взаимодействие играет часто основную роль в процессе диссоциации. Поэтому в этиловом спирте хлористый водород диссоциирует в сильной степени, а в динитробензоле в очень слабой, хотя диэлектрические проницаемости этих растворителей различаются незначительно.
Работа разъединения ионов при растворении производится главным образом за счет их сольватации (сопровождающейся уменьшением изобарного потенциала системы).
Подобное взаимодействие с молекулами растворителя свойственно не только ионным молекулам, но и молекулам с сильной полярной связью, хотя и в более слабой степени. Это взаимодействие и приводит к диссоциации такой молекулы на ионы. Именно гидратация ионов препятствует обратному соединению ионов в молекулы.
Теплотой гидратации (или энергией гидратации) принято называть количество энергии, отвечающей процессу перевода ионов из газообразного состояния в раствор.
Большое количество энергии, выделяющейся при гидратации (сольватации) ионов, в значительной степени облегчает эндотермический сам по себе процесс диссоциации электролита и вместе с тем стабилизирует ионы, затрудняя обратный процесс их взаимного соединения.
Поможем написать любую работу на аналогичную тему

