Пусть насыщенный раствор какого-нибудь сильного электролита вида В2А3 находится в равновесии со своими кристаллами:
В2А3 кр. « 2В3+ + 3А2-.
Константа равновесия будет равна
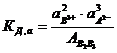 , (7.11)
, (7.11)
где аВ3+ и аА2- - активности ионов в растворе; АВ2В3 – активность электролита в осадке.
Так как АВ2В3 при каждой данной температуре постоянна, то и числитель правой части приведенного уравнения при данной температуре тоже является величиной постоянной:
![]() . (7.12)
. (7.12)
Постоянная La носит название произведения растворимости, если в растворе отсутствуют другие электролиты, образующие ионы, например в случае раствора AgCl, то
![]() .
.
Учитывая малую растворимость хлористого серебра, можно от активностей перейти к концентрациям. Тогда
![]()
и растворимость хлористого серебра равна
![]() .
.
Если к насыщенному раствору хлористого серебра прибавить электролит, содержащий один общий с ним ион, то увеличение общей концентрации, например ионов Cl-, вызовет уменьшение концентрации Ag+.
Прибавление электролита, не содержащего общих ионов, может влиять на растворимость электролита лишь в той степени, в которой возрастание ионной силы раствора будет вызывать изменение коэффициентов активностей и, следовательно, самих активностей.
Поможем написать любую работу на аналогичную тему

