Хотя вода часто рассматривается как вещество, практически не диссоциирующее на ионы, однако в действительности в очень малой степени вода всегда диссоциирует по уравнению Н2О « Н+ + ОН-.
Правда, необходимо помнить, что водородные ионы всегда образуют в воде ионы гидроксония Н3О+. Но для простоты обычно используют в качестве обозначения ион Н+, так как это не отражается на выводах. В растворах, содержащих кислоты, образуемые ими водородные ионы влияют на положение равновесия в реакции. В случае щелочей на равновесие влияют ионы гидроксила. Для Н2О:
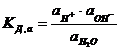 . (7.13)
. (7.13)
Для разбавленных растворов или для чистой воды вместо активности можно использовать концентрации:
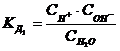 . (7.14)
. (7.14)
Степень диссоциации воды невелика, поэтому примем концентрацию ее постоянной и объединим с константой диссоциации воды в виде
Cн+ · Cон- = КВ,
где КВ – величина постоянная:
КВ = КД · CН2О . (7.15)
Эта постоянная носит название ионного произведения воды. При 25оС ионное произведение воды КВ = 1,008 · 10-14. В чистой воде, а также в любой другой нейтральной среде Cн+ = Cон- (условие нейтральности), тогда
Cн+ = Cон-= ![]() = 1,004 · 10-7 грамм-ионов в литре
= 1,004 · 10-7 грамм-ионов в литре
и, следовательно, степень диссоциации α равна
![]() .
.
Поможем написать любую работу на аналогичную тему

