Однозначная связь между концентрациями ионов водорода и ионов гидроксила используется для характеристики кислотности и щелочности различных сред. Эти два понятия равнозначны, однако условились использовать для характеристики растворов активность водородных ионов. Практически используется не сама величина аН+, а так называемый водородный показатель рН, который определяется формулой
рН = - lgаН+, (7.16)
для разбавленных растворов
рН = - lgСН+. (7.17)
Водородным показателем называется величина, характеризующая активность (или концентрацию) водородных ионов и численно равная отрицательному десятичному логарифму этой активности (или концентрации, выраженной в грамм-ионах на литр). При 25 оС в нейтральной среде рН = 7, но с повышением температуры (поскольку реакция эндотермична) степень диссоциации повышается и наоборот:
- lgаН+ - lgаОН- = 14; - lgаН+ = рН; - lgаОН- = рОН.
рН + рОН = 14 рН = 1 рОН = 13.
Тогда для сильных кислот:
HCl ® H+ + Cl- C(HCl) = C(H+) (для разбавленных растворов)
pН = -lgCH+.
Для растворов сильных оснований:
NaOH® Na+ + OH-;
C (NaOH) = COH-; pOH = - lgCOH-;
pH = 14 – pOH = 14 + lgCOH-.
Слабые кислоты и слабые основания диссоциируют не полностью. Их способность к диссоциации определяется константой диссоциации и степенью диссоциации. В этом случае взаимосвязь между рН, рК и концентрацией слабой кислоты выглядит следующим образом:
КД и С СН3СООН « СН3СОО- + Н+
![]() ,
,
если = CK, то:
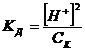 ;
; ![]()
-lg = ½ (-lgKД – lgCк);
рН = ½ рК – ½ lgCк .
Для слабых оснований
NH4OH « NH4+ + OH-
![]() ;
;
![]()
рОН = ½ рKосн –½ lgCосн; рН = 14 – ½ рKосн + ½ lgCосн .
Для слабых кислот существует следующая взаимосвязь между их концентрацией, степенью диссоциации и рН раствора:
рН = - lg (a× Ск).
В случае слабых оснований
pН = 14- рН = 14 + lga×Cосн .
Поможем написать любую работу на аналогичную тему

