Электроды (полуэлементы) взависимости от типа электродных реакций подразделяют на электроды первого и второго рода и окислительно-восстановительные (резокс-электроды). Электроды первого рода представляют собой металлические или газовые электроды, которые находятся в равновесии с соответствующими ионами в растворе, например цинковый электрод (цинк, погруженный в сульфат цинка), медный электрод (медь в растворе сульфата меди). Потенциалы этих электродов зависят лишь от активности (концентрации) в растворе ионов цинка или меди. К электродам первого рода относятся также газовые электроды, которые состоят из металлического проводника, контактирующего одновременно с газом, который пропускают через раствор, и с раствором, содержащим ионы этого газа (или ионы, образующиеся при взаимодействии газа с молекулами растворителя). Металлический электрод должен быть химически инертным относительно раствора и всех остальных составляющих электрохимической системы, чтобы исключить побочные электродные процессы. Очень часто таким металлом является платина. К газовым электродам относятся кислородный, хлорный, водородный электроды. На кислородном электроде протекает реакция
O2 + 2H2O + 4e- « 4OH-.
Потенциал кислородного электрода равен
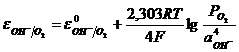 . (11.2)
. (11.2)
На хлорном электроде происходит реакция
![]() .
.
Потенциал хлорного электрода равен
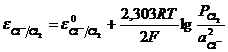 . (11.3)
. (11.3)
Наиболее широкое применение находит водородный электрод. В этом случае в раствор кислоты погружается платиновый электрод. Хорошо очищенный водород непрерывно подводится и протекает через раствор, контактируя с платиной. На электроде происходит реакция
![]() .
.
Потенциал водородного электрода следующий:
![]() . (11.4)
. (11.4)
Стандартный водородный электрод представляет собой платиновый проводник, насыщенный водородом при давлении pH2 = 0,1 МПа, погруженный в раствор с активностью ионов водорода ![]() . Как уже было сказано, член
. Как уже было сказано, член ![]() условно принят за нуль отсчета. Поэтому
условно принят за нуль отсчета. Поэтому
![]() . (11.5)
. (11.5)
относительно потенциала водородного электрода измерены стандартные потенциалы (25°С) для большого количества электродных реакций, что дает возможность решать различные электрохимические задачи.
При размещении стандартных электродных потенциалов для различных металлов так, чтобы их величины возрастали, получается ряд напряжений, известный из общего курса химии. Некоторые несоответствия между химическими свойствами металлов и величинами их стандартных электродных потенциалов связаны с тем, что последние зависят не только от активности металлов, но и от прочности солеватационной оболочки потенциал-определяющих ионов. Так, ионы лития из-за их малого размера прочно связаны с полярными молекулами воды, поэтому переход ионов лития из раствора в металл затруднен и его стандартный электродный потенциал отрицательнее потенциалов более активных металлов натрия и калия.
Электроды второго рода – это металлические электроды, на которые нанесен слой их труднорастворимых соединений (соли, оксиды или гидроксиды, погруженные в электролит, который содержит такой же анион, как и труднорастворимые соединения).
Эти электроды обратимы по отношению к указанным анионам, т.е. находятся с ними в термодинамическом равновесии. Схематично такой электрод можно записать так: ![]() .
.
На электроде происходит реакция
MA + ze- « M + ![]() .
.
Потенциал такого электрода равен
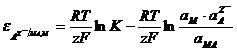 . (11.6)
. (11.6)
После преобразования получим:
![]() . (11.7)
. (11.7)
Концентрация (активность) металла М и твердой фазы МА равны единице. Поэтому при Т = const первый член первой части – величина постоянная, которую обозначим через ![]() (стандартный электродный потенциал).
(стандартный электродный потенциал).
Откуда
![]() . (11.8)
. (11.8)
Таким образом, величина потенциала электрода второго рода зависит только от концентрации анионов труднорастворимого соединения в растворе.
Величины потенциалов электродов второго рода сохраняются постоянными, хорошо воспроизводимы, и поэтому эти электроды используют в качестве стандартных электродов сравнения при измерении электродных потенциалов.
Наиболее широко известны электроды второго рода – каломельный, хлор-серебрянный и ртутно-сульфатный.
Схематично каломельный электрод можно записать так:
Cl- | Нg2Cl2, Hg,
где Hg2Cl2 – каломель.
На электроде происходит реакция
Hg2Cl2 + 2e- « 2Hg + 2Cl-
Потенциал электрода определяется только концентрацией ионов хлора. В практике используют каломельные электроды с насыщенным, нормальным и децинормальным растворами хлорида калия. Величины потенциалов этих электродов по водородной шкале приведены ниже.
В случае насыщенного раствора хлорида калия
![]() . (11.9)
. (11.9)
Для нормального раствора хлорида калия (C = 1N)
![]() . (11.10)
. (11.10)
Для децинормального раствора хлорида калия (C = 0,1N)
![]() . (11.11)
. (11.11)
Наиболее широкое распространение получил насыщенный каломельный электрод: он легко готовится, в нем автоматически поддерживается постоянная концентрация хлорида калия. Преимущество децинормального электрода заключается в существенно меньшей зависимости потенциала от температуры.
Хлор-серебрянный электрод представляет собой систему Cl- | AgCl, Ag. Его потенциал равен
![]() ; (11.12)
; (11.12)
при 20 °С
![]() . (11.13)
. (11.13)
Ртутно-сульфатный электрод – это система SO42- | HgSO4, Hg.
При 20 °С его потенциал равен
![]() . (11.14)
. (11.14)
В принципе все электроды представляют собой окислительно-восстановительную систему. Однако принято называть окислительно-восстановительными электродами электроды, на которых происходят окислительно-восстановительные реакции, не сопровождающиеся фазовыми переходами. Металл в редокс-электроде не принимает участия в электродной реакции, а выполняет лишь функцию переносчика электронов (как и в газовых электродах).
Различают простые редокс-электроды, на которых происходит реакция, приводящая только к изменению заряда ионов:
Sn4+ + 2e- « Sn2+
MnO4- + e- « MnO42-.
Величины электродных потенциалов этих электродов определяются отношением активности окисленной формы ионов к восстановленной:
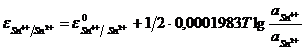 (11.15)
(11.15)
или
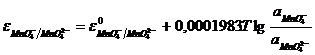 , (11.16)
, (11.16)
где ![]() и
и ![]() – стандартные окислительно-восстановительные потенциалы.
– стандартные окислительно-восстановительные потенциалы.
В реакциях на сложных редокс-электродах обычно принимают участие ионы водорода, ионы OH- или молекулы воды:
MnO4- + 8H3O+ + 5e- « Mn2+ + 12 H2O;
SO42- + H2O + 2e- « SO32- + 2OH-;
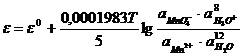 ; (11.17)
; (11.17)
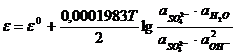 . (11.18)
. (11.18)
Величина окислительно-восстановительного потенциала является мерой восстановительной или окислительной способности раствора. Чем сильнее восстановительные свойства раствора, тем более отрицательный потенциал приобретает электрод, и наоборот.
Существуют также амальгамные электроды, которые представляют собой полуэлементы, в которых амальгама какого-либо металла находится в контакте с раствором, содержащим его ионы M2+ú M, Hg. Для большинства амальгам ртуть не принимает участия в электродной реакции, и соответственно потенциал амальгамного электрода определяется реакцией
MZ+ú ze- « M.
Величина потенциала зависит от активности (концентрации) металла в амальгаме и от активности ионов металла в растворе:
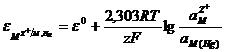 . (11.19)
. (11.19)
Амальгамные электроды широко используются в практике. Так, 12,5%-ная амальгама кадмия входит в состав полуэлемента нормального кадмиевого элемента (элемента Вестона), применяемого в качестве эталона при измерении ЭДС. Потенциал кадмиевого амальгамного электрода равен
![]() . (11.20)
. (11.20)
Поможем написать любую работу на аналогичную тему

