На границе двух неодинаковых растворов всегда возникает разность потенциалов, которая называется диффузионным потенциалом. Возникновение такого потенциала связано с неодинаковой подвижностью катионов и анионов, находящихся в растворе. Величина диффузионных потенциалов обычно не превышает нескольких десятков милливольт, и их, как правило, не учитывают. Однако при точных измерениях принимают специальные меры для максимального их уменьшения.
Причины возникновения диффузионного потенциала показали на примере двух граничащих растворов сульфата меди разной концентрации. Ионы Cu2+ и SO42- будут диффундировать через границу раздела из более концентрированного раствора в менее концентрированный. Скорости перемещения ионов Cu2+ и SO42- неодинаковы: подвижность ионов SO42- больше подвижности Cu2+. В результате этого на границах раздела растворов со стороны раствора с меньшей концентрацией возникает избыток отрицательных ионов SO42-, а в более концентрированном – избыток Cu2+. Возникает разность потенциалов. Наличие избыточного отрицательного заряда на границе раздела будет тормозить движение SO42- и ускорять движение Cu2+. При некотором значении потенциала скорости SO42- и Cu2+ станут одинаковыми; установится стационарное значение диффузионного потенциала.
Теория диффузионного потенциала была развита М. Планком (1890 г.), а впоследствии А. Гендерсоном (1907 г.). Полученные ими формулы для расчета сложны. Но решение упрощается, если диффузионный потенциал возникает на границе двух растворов с разными концентрациями С1 и С2 одного и того же электролита. В этом случае диффузионный потенциал ![]() равен
равен
![]() , (11.21)
, (11.21)
где U и V – подвижности катиона и аниона.
Для концентрированных растворов вместо ![]() следует использовать
следует использовать ![]() .
.
Простая формула получается для расчета потенциала на границе раздела растворов равных концентраций бинарных электролитов с общим катионом или анионом, например NaCl и KCl или KCl и KNO3 в равных концентрациях.
В первом случае
![]() , (11.22)
, (11.22)
где U1 и U2 – подвижности ионов Na+ и K+, а V – подвижность Cl-.
Во втором случае
![]() , (11.23)
, (11.23)
где U – подвижность иона K+, а V1 и V2 – подвижность ионов Cl- и NO3-. Отношение ![]()
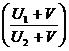 или
или 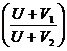 можно заменить отношением эквивалентных электрических проводимостей l1/l2, так как
можно заменить отношением эквивалентных электрических проводимостей l1/l2, так как ![]() :
:
![]() . (11.24)
. (11.24)
Диффузионные потенциалы возникают при неравновесных процессах диффузии, поэтому они необратимы. Их величина зависит от характера границы двух соприкасающихся растворов, от величины и их конфигурации. При точных измерениях используются методы, позволяющие сводить к минимуму величину диффузного потенциала. С этой целью между растворами в полуэлементах включают промежуточный раствор с возможно более низкими величинами подвижностей U и V (например, KCl и KNO3).
Разность потенциалов возникает и на границе соприкосновения несмешивающихся жидкостей. Положительные и отрицательные ионы в этих растворителях распределяются неравномерно, их коэффициенты распределения не совпадают. Поэтому на границе раздела жидкостей возникает скачок потенциала, который препятствует неодинаковому распределению катионов и анионов в обоих растворителях. В общем (суммарном) объеме каждой фазы количество катионов и анионов практически одинаково. Оно будет отличаться только на поверхности раздела фаз. Это и есть межжидкостный потенциал.
Диффузные и межжидкостные потенциалы играют большую роль в биологии. Их возникновение не связано с металлическими электродами. Именно межфазные и диффузионные потенциалы порождают биотоки. Например, у электрических скатов и угрей создается разность потенциалов до 450 В. Биопотенциалы чувствительны к физиологическим изменениям в клетках, органах. На этом основано применение методов электрокардиографии и электроэнцефалографии (измерение биотоков сердца и мозга).
Поможем написать любую работу на аналогичную тему

