Электрохимические системы с химической реакцией подразделяются на простые и сложные. К простым химическим цепям относятся системы, в которых реакции на электродах протекают только вследствие различий свойств электродов, погруженных в один и тот же раствор. Один из электродов при этом обратим по отношению к катионам, другой – относительно анионов, например:
(-) Sn | SnCl2 | Cl2, Pt (+).
На электродах протекают реакции
Sn2+ + 2e- « Sn
Cl2 + 2e- « 2Cl- .
Sn2+ + 2Cl- « Sn + Cl2
Потенциал правого электрода равен
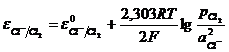 . (11.25)
. (11.25)
Потенциал левого электрода равен
![]() . (11.26)
. (11.26)
ЭДС цепи составляет
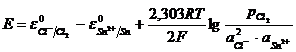 , (11.27)
, (11.27)
Так как ![]() представляет собой среднюю ионную активность электролита, то
представляет собой среднюю ионную активность электролита, то
![]() ,
,
т.е. ЭДС простой химической цепи зависит от природы электродов и от средней ионной активности электролита. К сложным электрохимическим системам относятся системы, в которых одинаковые или различные металлические электроды погружены в различные по составу электролиты:
(-) Zn | ZnSO4 || CuSO4 | Cu (+).
На электродах протекают следующие реакции:
Zn ® Zn2+ + 2e-;
Cu2+ + 2e- ® Cu.
E цепи равна
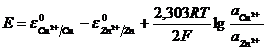 . (11.28)
. (11.28)
ЭДС сложных химических цепей определяются разностью стандартных потенциалов электродов и активностью потенциал-определяющих ионов (т.е. ионов, обратимых по отношению к электродам).
Поможем написать любую работу на аналогичную тему

