Адсорбция на границе раздела твердое тело/газ. В общем случае явления, связанные с перераспределением веществ между различными частями гетерогенной системы, называются сорбцией. Сорбция (от лат. sorbeo – сгущать) – это изменение концентрации (часто увеличение) либо у поверхности раздела фаз (адсорбция), либо в объеме одной из фаз (абсорбция). Например, образование раствора за счет поглощения НСl (газа) и поглощение газа металлом (абсорбция). Поверхностная сорбция – адсорбция.
Твердое тело, у поверхности которого происходит адсорбция, называется адсорбентом, адсорбирующийся газ или адсорбирующийся компонент жидкого раствора – адсорбтивом, а адсорбированое вещество – адсорбат.
В строгом определении адсорбции она рассматривается как избыток вещества вблизи поверхности по сравнению с равным объемом вдали от нее. В ряде случаев удобнее рассматривать не избыток, а все количество адсорбата вблизи поверхности. Это количество обозначают символом а и называют полным содержанием, или просто адсорбцией (без указания гиббсова). Так как для пористых твердых тел бывает затруднительно знать величину поверхности, то часто адсорбцию относят не к единице поверхности, а к единице массы (моль/кг или моль/г).
Адсорбция самопроизвольна и протекает при Р = const со снижением энергии Гиббса, а при V = const – со снижением энергии Гельмгольца. Однако при этом происходит не выравнивание концентраций по всему объему системы, а увеличение разности концентраций между газовой фазой (раствором) и поверхностью. Одновременно уменьшается подвижность сорбирующихся молекул. Оба фактора ведут к уменьшению энтропии (DS<0).
По основному уравнению термодинамики находим
DH = TDS + DG (13.16)
Если величины DS и DG – отрицательны, то значение DН – отрицательно и процесс является экзотермическим.
Важной характеристикой адсорбции является теплота адсорбции. Она является мерой интенсивности адсорбционных сил – сил взаимодействия молекул адсорбата с поверхностью адсорбента и между собой.
Интенсивность взаимодействия адсорбент-адсорбат зависит от состояния адсорбента и от того, какое количество адсорбата уже адсорбировано (от заполнения поверхности). Поэтому различают два основных понятия – интегральная и дифференциальная теплота адсорбции.
Интегральной теплотой адсорбции Q называется полное количество теплоты, выделяющейся при адсорбции n молей адсорбата. Ее относят к единице массы адсорбента (Дж/кг). Дифференциальной теплотой адсорбции q называют отнесенное к 1 молю адсорбата дополнительное количество теплоты, выделяющейся при адсорбции бесконечно малого количества адсорбата:
![]() или
или 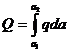 . (13.17)
. (13.17)
Типичные зависимости интегральной и дифференциальной теплоты адсорбции от количества адсорбированного вещества представлены на рисунке 13.2. Прямые 1 для Q и 2 для q соответствуют зависимости Q = ka. Как правило, такая прямая зависимость не наблюдается (она возможна лишь при q = const). Фактически вследствие неоднородности поверхности адсорбента адсорбция происходит сначала на наиболее активных участках поверхности с наибольшим значением дифференциальной теплоты; при больших заполнениях q уменьшается. Это приводит к некоторому замедлению роста Q. Возможен и третий случай. Вследствие взаимного притяжения адсорбированных молекул уменьшается расстояние между ними и дифференциальная теплота адсорбции повышается (кривая 3).
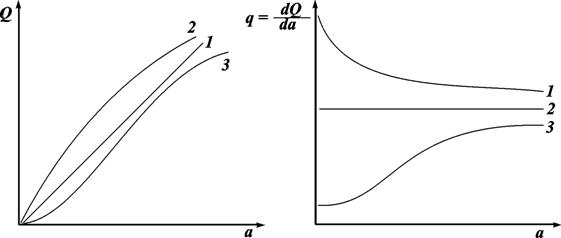
Рис. 13.2. Зависимость интегральной и дифференциальной теплоты адсорбции от количества адсорбированного вещества
Поможем написать любую работу на аналогичную тему

