Для данной пары адсорбент – адсорбат величина адсорбции а или Г определяется двумя основными термодинамическими параметрами состояния: температурой Т и давлением Р для газообразного состояния адсорбата или Т и концентрацией С при адсорбции из растворов. Все три величины связаны функциональной зависимостью, называемой термическим уравнением обратимой сорбции:
f = (a,Р,T) = 0 или j = (Г,С,Т) = 0. (13.18)
В теории адсорбции особенно часто рассматривают адсорбционное равновесие при условии, что один из параметров, входящих в термическое уравнение, поддерживается постоянным. Например, а = f(P)Т или Г = j (С)Т. Адсорбия, если она выражена не как избыток, а как полное содержание, всегда возрастает с повышением равновесного давления (концентраци). Так как адсорбция – процесс экзотермический, то при повышении температуры величина адсорбции снижается.
Уравнение, связывающее величину адсорбции с температурой при постоянном равновесном давлении а = f(T)P или постоянной равновесной концентрации Г = j(Т)С, носит название соответственно изобары или изопикны адсорбции. Уравнение вида Р = f(Т)а (изостера адсорбции) связывает равновесное давление с температурой при постоянном адсорбированном количестве.
Переход вещества из газовой фазы в адсорбированное состояние в известном смысле аналогичен фазовому переходу пар-жидкость. Поэтому для такого перехода может быть выведена формула, аналогичная формуле Клаузиуса-Клапейрона. Однако в этом случае в формулу входит частная производная давления по температуре при постоянном значении адсорбции (¶Р/¶Т)a:
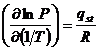 , (13.19)
, (13.19)
где qst – изостерическая теплота адсорбции, которая очень близка к выведенной ранее дифференциальной теплоте.
Для математического описания адсорбции необходимо уравнение, которое связывает зависимость равновесной величины адсорбции от концентрации адсорбата в объемной фазе при различных температурах, а также правильно предсказывает изменение теплоты адсорбции от заполнения адсорбента.
Однако форма изотермы адсорбции на твердых телах зависит от многих параметров: свойств адсорбента и адсорбата, взаимодействия адсорбтив/адсорбат, взаимодействия молекул адсорбата между собой в газовой фазе и в адсорбированном состоянии. В области малых давлений (концентраций) и малых заполнений поверхности взаимодействия между молекулами адсорбата незначительны и зависимость а = f(P)T сводится к простейшей форме, называемой законом Генри:
а = kP или а = kC. (13.20)
Коэффициент пропорциональности k – коэффициент Генри – является мерой интенсивности адсорбции. При больших давлениях (концентрациях) и больших заполнениях адсорбцию часто выражают эмпирическим уравнением Фрейндлиха
![]() , (13.21)
, (13.21)
где х – количество адсорбированного вещества, m – масса адсорбента, b и n – константы, характерные для каждой адсорбционной системы. Причем 1/n всегда правильная дробь (0 < 1/n < 1). По Г. Фрейндлиху, n не зависит от заполнения, хотя это не вполне точно. Этим уравнением часто пользуются для ориентировочной оценки адсорбции.
Поможем написать любую работу на аналогичную тему

