В конце 19 начале 20 веков бурно развивалась спектроскопия. Самым простым для изучения материалом является водород, поэтому наибольшее число работ было посвящено изучению спектров атома водорода. Исследуемые спектры были линейчатыми. Особенность водородных спектров заключалась в том, что линии излучения и поглощения располагались группам, которые были названы сериями. Одна из спектральных серий лежит в видимой области, одна – в ультрафиолетовой, остальные – в инфракрасной. Частоты спектральных линий хорошо описывались обобщенной формулой Бальмера.
 (1)
(1)
Где R = 3,29×1015 с-1 – константа Ридберга, а n и m – целые числа. Аналогичная формула имеет место для длин волн, где R¢ = 1,10×107 м-1:
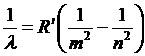 (2)
(2)
Целое число m определяет спектральную серию: n = 1 серия Лаймана
n = 2 серия Бальмера
n = 3 серия Пашена
n = 4 серия Бреккета
n = 5 серия Пфунда
n = 6 серия Хэмфри
n = 7 серия Пиккеринга
Для объяснения полученных формул, а именно физического смысла чисел n и m были разработаны атомные модели.
1) Модель Томпсона.
Атом представляет собой массивный положительный заряд, занимающий практически весь объем атома, а точечные электроны равномерно распределены по его поверхности. Предполагалось, что электроны колеблются около положения равновесия и частота их колебания совпадает с частотой излучения света. Проблема заключалась в том, что согласно законам классической электродинамики, ускоренно движущаяся частица должна излучать. Если колеблющиеся электроны излучают – теряется энергия, следовательно, должна равномерно уменьшаться частота их колебания, и спектр излучения должен быть сплошным. Таким образом, модель объясняет сам факт излучения, но не объясняет физический смысл чисел n и m.
2) Модель атома Резерфорда.
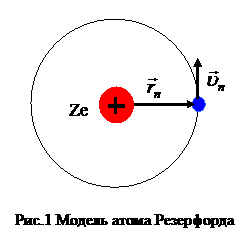
На основании проведенного эксперимента Резерфорд заключил, что размер атома, в основном, определяется электронной оболочкой, масса атома определяется ядром, размер которого значительно меньше размеров оболочки. Электроны вращаются вокруг ядра по круговым орбитам, как планеты вокруг Солнца, поэтому, модель атома Резерфорда была названа планетарной. Предполагалось, что при переходе электронов между орбитами атом излучает или поглощает свет, в результате этих переходов формируется спектр атома. Целые числа в формуле Бальмера соответствуют номерам орбит, между которыми происходит переход: m – уровень, на который осуществляется переход, n – уровень, с которого осуществляется переход.
Проблема объяснения формирования спектров осталась прежней – ускоренно движущиеся по орбитам электроны должны излучать, следовательно, терять энергию, что должно приводить к уменьшению радиусов их орбит. В результате электроны должны были опуститься на ядро. Однако, последняя модель не только описывала факт излучения атома, но и объясняла сериальные закономерности, поэтому, для правомерности ее применения Бор сформулировал три постулата:
а) Существуют такие стационарные состояния, в которых атом не поглощает и не излучает энергию
б) При переходе между двумя стационарными состояниями атом излучает или поглощает квант света, энергия которого равна разности энергий состояний
![]() (3)
(3)
в) Момент импульса электрона в атоме является квантованной величиной
![]() (4)
(4)
Где un – скорость электрона на n-ной боровской орбите, rn – радиус соответствующей боровской орбиты, n – номер орбиты, m – масса электрона.
Применяя постулаты Бора к модели атома водорода (рис.1) легко получить обобщенную формулу Бальмера:
 Рассмотрим электрон, движущийся по n-ной боровской орбите. Кулоновская сила взаимодействия электрона с ядром сообщает электрону нормальное ускорение и по второму закону Ньютона
Рассмотрим электрон, движущийся по n-ной боровской орбите. Кулоновская сила взаимодействия электрона с ядром сообщает электрону нормальное ускорение и по второму закону Ньютона 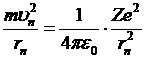
Согласно третьему постулату Бора ![]() , отсюда радиус n-ной боровской орбиты
, отсюда радиус n-ной боровской орбиты 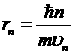 (5); скорость на этой орбите
(5); скорость на этой орбите  (6)
(6)
Полная энергия электрона на n-ной боровской орбите складывается из кинетической энергии электрона и его потенциальной энергии кулоновского взаимодействия с ядром:  . Подставляя (5) и (6) получим:
. Подставляя (5) и (6) получим: 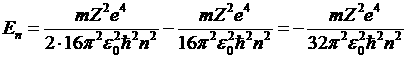 , для атома водорода заряд ядра Z = 1. Таким образом, электрон в атоме водорода способен принимать строго дискретный набор энергий, определенный целым числом n – главным квантовым числом.
, для атома водорода заряд ядра Z = 1. Таким образом, электрон в атоме водорода способен принимать строго дискретный набор энергий, определенный целым числом n – главным квантовым числом.
Применяя второй постулат Бора, получим обобщенную формулу Бальмера  , тогда значение постоянной Ридберга
, тогда значение постоянной Ридберга 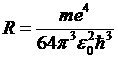 (7). Расчет последней дает хорошее согласование с экспериментальным значением.
(7). Расчет последней дает хорошее согласование с экспериментальным значением.
Поможем написать любую работу на аналогичную тему

