Количеству клеток в единице объема - титр клеток (или фаговых частиц).
Чтобы определить общее количество микроорганизмов в различных материалах, применяют методы прямого подсчета клеток под микроскопом (в специальных счетных камерах, в фиксированных мазках, намембранных фильтрах).
Подсчет клеток в окрашенных препаратах (метод Виноградского–Брида)
Преимущество: фиксированные окрашенные препараты хорошо сохраняются.
Техника: а) на хорошо обезжиренном предметном стекле маркером рисуют прямоугольник строго известной площади (2, 4 или 6 см2), б) на стекло в прямоугольник микропипеткой (или автоматической
пипеткой) наносят определенный объем суспензии клеток (0,01; 0,02 или 0,03 мл), в) суспензию равномерно распределяют петлей по всей площади прямоугольника, г) препарат высушивают на воздухе и фиксируют 15 мин 96 % этанолом, д) проводят окрашивание фуксином Циля 1 – 2 мин,
е) краситель сливают, препарат промывают водой, последовательно погружая стекло в 5 – 6 стаканов с водой) и высушивают на воздухе.
Количество клеток микроорганизмов подсчитывают, используя иммерсионный объектив, в квадратах окулярной сетки, которую помещают в окуляр между собирательной и глазной линзами.
Для получения достоверных результатов клетки микроорганизмов рекомендуется подсчитывать не менее чем в 50 – 100 полях зрения, а общее количество подсчитанных клеток не должно быть менее 600.
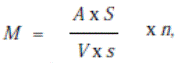 М – количество кл-ок в 1 мл; А – среднее число кл-к в квадрате
М – количество кл-ок в 1 мл; А – среднее число кл-к в квадрате
окулярной сетки (поле зрения); s и S – площадь квадрата окулярной
сетки (поля зрения) и приготовленного мазка в мкм2 соответственно;
V – объем нанесенной на стекло суспензии в мл; n – разведение.
2. Подсчет клеток на мембранных фильтрах
Этот метод используют для подсчета количества микроорганизмов в жидких материалах с низкой плотностью клеток. Метод основан на концентрировании клеток на поверхности фильтра в результате
фильтрации определенного объема исследуемой пробы с окрашиванием и подсчетом в микроскопе.
С помощью мембранного фильтрования могут быть подсчитаны как жизнеспособные клетки микроорганизмов, так и определено общее количество клеток. Техника: 1. Собирают прибор для фильтрования под вакуумом. Дляэтого основание стерильного фильтродержателя вставляют в стериль-
ную колбу Бунзена, с помощью стерильного пинцета помещают в фильтродержатель стерильный фильтр и закрепляют зажимом. Отводной конец колбы Бунзена соединяют с вакуумным насосом.
2. Строго определенный объем исследуемого материала пропускают через мембранный фильтр, создавая с помощью насоса вакуум. 3. Фильтр, с осевшими клетками микроорганизмов, снимают сте-
рильным пинцетом и исследую в зависимости от целей эксперимента.
Проводят окрашивание фильтра 5 % раствором эритрозина в 5 % растворе фенола. Для этого фильтр помещают нижней стороной в чашкуПетри на фильтровальную бумагу, насыщенную красителем, чашкузакрывают и оставляют на 30 – 60 мин. Фильтр отмывают от красителя, последовательно перенося его в чашки Петри с фильтровальной бумагой, насыщенной дистиллированной водой до тех пор, пока он не перестанет окрашивать влажную фильтровальную бумагу. Фильтр высушивают на воздухе и готовят препарат для микроскопирования. На предметное стекло накапывают иммерсион-
ное масло и помещают на него окрашенный мембранный фильтр таким образом, чтобы клетки микроорганизмов были сверху. На поверхность фильтра наносят еще каплю иммерсионного масла и по-
крывают фильтр покровным стеклом.
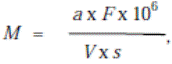 где М – количество клеток в 1 мл; а – среднее число клеток в квадрате
где М – количество клеток в 1 мл; а – среднее число клеток в квадрате
окулярной сетки (поле зрения); s и F – площадь квадрата окулярной
сетки (поля зрения) и мембранного фильтра в мм2, соответственно;
V – объем профильтрованной суспензии в мл; 106 – коэффициент пе-
ревода мм2 в мкм2.
При подсчете колоний для увеличения контрастности мембранный фильтр с колониями окрашивают. Для этого поверхность фильтра, находящегося в чашке Петри, заливают 0,01 % водным раствором окса-
лата малахитового, который через 8 – 10 с сливают. При этом способе окрашивания колонии выглядят белыми или желтыми на фоне зеленого фильтра.
Метод подсчета клеток на мембранных фильтрах с помощью люминесцентного микроскопа заключается в концентрировании бактерий из исследуемого материала на нелюминесцирующий мембранный фильтр, флюорохромировании акридиновым оранжевым и подсчете клеток в специальном (люминесцентном) микроскопе. Этот метод удобен тем, что позволяет непосредственно подсчитать как общее количество клеток, так и количество жизнеспособных клеток. При окрашивании акридиновыми красителями жизнеспособные клетки имеют зеленую, а нежизнесобные (мертвые) – красную окраску.
Определение количества микробных клеток нефелометрическим методом точно и сравнительно быстро определить количество клеток в культуральной среде. В определенных пределах рассеивание света клетками пропорционально их численности. Величину светорассеяния измеряют с помощью нефелометров, спектрофотометров или фотоэлектроколориметров.
Для построения калибровочной кривой поступают следующим образом. Измеряют величину светорассеяния взвеси с различным содержанием клеток и в каждой из них одним из доступных способов подсчитывают количество клеток в единице объема. Полученную зависимость выражают графически, откладывая на осях: абсцисс – показания нефелометра, ординат – количество клеток, содержащихся в 1 мл. Калибровочные кривые индивидуальны для каждой культуры.
Определение количества жизнеспособных клеток путем высева на питательные среды (чашечный метод Коха) Сущность метода подсчета количества клеток путем высева заклю-
чается в высеве определенного объема исследуемой суспензии микроорганизмов на агаризованную питательную среду в чашках Петри и подсчете формирующихся колоний, принимая во внимание, что каждая колония – потомство одной жизнеспособной клетки.
При посеве на поверхность агара (метод Коха) проводят три этапа: приготовление разведений исследуемого материала, посев на агаризованную среду в чашках Петри и подсчет сформировавшихся колоний.Разведения готовят в физиологическом растворе, используя шаг разведения 10-1.
Высевы на плотную среду проводят, как правило, из трех последних разведений, причем делают два параллельных высева на отдельные чашки.
При расчете количества клеток микроорганизмов в 1 мл исходной суспензии суммируют результаты параллельных высевов из одного и того же разведения и определяют среднее количество колоний для
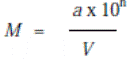 данного разведения. Лучшим разведением следует считать то, при высеве из которого на агаризованной питательной среде сформировалось от 30 до 300 колоний.
данного разведения. Лучшим разведением следует считать то, при высеве из которого на агаризованной питательной среде сформировалось от 30 до 300 колоний.
где М – количество клеток в 1 мл; а – среднее количество колоний при
высеве из данного разведения; V – объем 84 асуспензии в мл, взятой для
посева; 10 – коэффициент разведения; n – порядковый номер разведения.
Метод посева в агаризованную среду осуществляют путем внесения в стерильную чашку Петри суспензии микроорганизмов из соответствующего разведения с последующим заливанием расплавленной и охлажденной агаризованной средой. Содержим. чашки перемеш. и дают среде застыть.
Метод посева в тонком слое предполагает внесение разведенной суспензии микроорганизмов в пробирки с небольшим объемом (2,5 – 3,5 мл) расплавленной полужидкой агаризованной средой, которую затем разливают по стерильным чашкам, уже содержащим один слой застывшей агаризованной среды и дают застыть верхнему слою.
Поможем написать любую работу на аналогичную тему

