Экспериментальный метод изучения фармакологических веществ осуществляется на лабораторных животных разных видов, смотря по задачам исследования.
Программа обычно строится по следующей схеме.
- Во-первых, определяется так называемый спектр фармакологического действия, т. е. прежде всего выясняется, на какие физиологические функции они оказывают влияние.
- Во-вторых, устанавливается острая и хроническая токсичность препарата, причем она должна быть выражена в точных величинах, достоверность которых проверяется статистическими методами.
- В-третьих, изучение новых средств, особенно химиотерапевтических, проводится в условиях патологии, т. е. на больных животных.
- В-четвертых, рекомендуется проверять терапевтическую ценность новых средств в плане экспериментальной терапии.
В этом случае испытания проводятся на животных, у которых искусственным путем вызываются заболевания, имеющие сходство с болезнями у людей. Другими словами, испытания проводятся на «моделях».
После получения достаточно полной информации о фармакологических свойствах изучаемых веществ в результате экспериментальных исследований их передают для испытания в клинику при условии, конечно, что они проявляют отчетливо выраженную фар макотерапевтическую активность. Клинические испытания новых препаратов имеют решающее значение для их окончательной оценки.
Предмет экспериментальной фармакологии составляет моделирование механизмов взаимодействия ЛС с биологическими системами (организм человека или экспериментального животного) на различных уровнях (субклеточный, тканевой, органный, системный) и изучение возникающих при этом эффектов.
В экспериментальной фармакологии, можно выделить три основных методических подхода: биохимический; физиологический; морфологический.
Используя биохимический подход, фармакология изучает природу реакций взаимодействия между лекарственным веществом и биомолекулами. Используя физиологический и морфологический подходы, фармакология анализирует изменения функции и строения органов и систем, вызываемых фармакологическим воздействием.
Поиск новых лекарственных средств
Создание лекарств начинается с исследований химиков и фармакологов, поиск новых средств развивается по нескольким направлениям.
I. Химический синтез препаратов
А. Направленный синтез:
1) воспроизведение биогенных веществ;
2) создание антиметаболитов;
3) модификация молекул соединений с известной биологической активностью;
4) изучение структуры субстрата, с которым взаимодействует лекарственное средство;
5) сочетание фрагментов структур двух соединений с необходимыми свойствами;
6) синтез, основанный на изучении химических превращений веществ в организме (пролекарства; средства, влияющие на механизмы биотрансформации веществ).
Б. Эмпирический путь: 1)случайные находки; 2) скрининг. // empirical = depending upon experience or observation alone, without using scientific method or theory
II. Получение препаратов из лекарственного сырья и выделение индивидуальных веществ:
1) животного происхождения;
2) растительного происхождения;
3) из минералов.
III. Выделение лекарственных веществ, являющихся продуктами жизнедеятельности грибов и микроорганизмов; биотехнология (клеточная и генная инженерия)
Основным путем является ХИМИЧЕСКИЙ синтез препаратов, который может реализоваться в виде НАПРАВЛЕННОГО синтеза или иметь ЭМПИРИЧЕСКИЙ путь.
Направленный синтез связан с воспроизведением биогенных веществ (инсулин, адреналин, норадреналин), созданием антиметаболитов (ПАБК-сульфаниламиды), и т. д., то эмпирический путь состоит или из случайных находок, либо поиска путем скрининга, то есть просеивания различных химических соединений на фармакологическую активность.
Одним из примеров эмпирических находок может быть приведен случай обнаружения гипогликемического эффекта при использовании сульфаниламидов, что впоследствии привело к созданию сульфаниламидных синтетических противодиабетических средств (бутамид, хлорпропамид).
Весьма трудоемок и другой вариант эмпирического пути создания лекарств - МЕТОД СКРИНИНГА.
Новое лекарственное средство, пройдя через все эти "сита" (исследование фармактивности, фармакодинамики, фармакокинетики, изучение побочных эффектов, токсичности и т. д.) допускается на клинические испытания.
Схемы исследования новых лекарственных средств
![]() Краткая характеристика основных этапов при разработке новых лекарств.
Краткая характеристика основных этапов при разработке новых лекарств.
|
Этап |
Краткая характеристика |
|
Доклинические испытания
После завершения материалы передаются для экспертизы в Фармакологический комитет, который санкционирует проведение клинических испытаний. |
|
|
Клинические испытания
|
|
После завершения III фазы клинических испытаний документация вновь поступает в Фармакологический комитет (объем полного досье может составлять до 1 млн. страниц) и в течение 1-2 лет регистрируется в Государственном реестре лекарственных средств и изделий медицинского назначения. Только после этого фармакологический концерн имеет право начать промышленный выпуск лекарственного средства и его распространение через аптечную сеть.
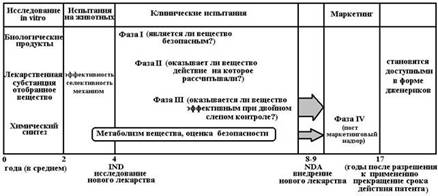
IV фаза клинических испытаний (постмаркетинговые исследования). Цель этой фазы – выявить редко встречающиеся, но потенциально опасные нежелательные эффекты лекарства.
При организации и проведении клинических испытаний должны выполняться следующие требования: Исследование должно быть рандомизированным, контролируемым – т.е. параллельно с группой принимающей исследуемое лекарство, должна быть набрана группа, которая получает стандартный препарат сравнения (позитивный контроль) или неактивный препарат, который внешне имитирует изучаемое лекарство (плацебо контроль).
Здесь используется метод "слепого контроля", эффект плацебо, метод двойного "слепого контроля", когда ни врач, ни больной не знает, когда это плацебо используется. Знает только специальная комиссия. Клинические испытания проводятся на людях, и во многих странах это осуществляется на добровольцах. Здесь, безусловно, возникает масса юридических, деонтологических, нравственных аспектов проблемы, которые требуют своей четкой разработки, регламентации и утверждения законов на данный счет.
Международные стандарты GLP, GCP, GMP
С целью повышения качества медицинской помощи была разработана серия надлежащих практик GxP. Система GxP охватывает все этапы жизненного цикла лекарственного средства, от фармацевтической разработки до конечного потребителя, а именно:
- Доклинические (лабораторные) исследования, которые регулируются правилами GLP (Good Laboratory Practice, Надлежащая лабораторная практика),
- Клинические испытания, которые регулируются правилами GCP (Good Clinical Practice, Надлежащая клиническая практика),
- Производство, которое регулируется правилами GMP (Good Manufacturing Practice, Надлежащая производственная практика),
GCP – надлежащая клиническая практика (Good Clinical Practice). Стандарт для клинических испытаний, охватывающий планирование, проведение, завершение, проверку, анализ результатов, составление отчетов и ведение документации, обеспечивающий научную значимость исследований, этическую приемлемость и полную документированность клинических характеристик терапевтического (диагностического, профилактического) продукта.
GLP – надлежащая лабораторная практика (Good Laboratory Practice). Набор критериев, соблюдение которых необходимо в качестве основы оценки результатов и выводов лабораторных исследований.
![]() GMP – надлежащая производственная практика (Good Manifacturing Practice). Часть системы обеспечения качества, которая гарантирует, что продукция постоянно производится и контролируется по стандартам качества, соответствующим её назначению и требуемым торговой лицензией.
GMP – надлежащая производственная практика (Good Manifacturing Practice). Часть системы обеспечения качества, которая гарантирует, что продукция постоянно производится и контролируется по стандартам качества, соответствующим её назначению и требуемым торговой лицензией.
- Хранение, которое регулируется правилами GSP (Good Service Practice, Надлежащая практика обслуживания, хранения),
- Оптовая торговля, которая регулируется правилами GDP (Good Distribution Practice, Надлежащая практика оптовой продажи),
- Розничная торговля, которая регулируется правилами GPP (Good Participatory Practice, Надлежащая практика розничной продажи).
Поможем написать любую работу на аналогичную тему
Реферат
Сущность метода экспериментальной терапии и его роль в фармакологических исследованиях.
От 250 руб
Контрольная работа
Сущность метода экспериментальной терапии и его роль в фармакологических исследованиях.
От 250 руб
Курсовая работа
Сущность метода экспериментальной терапии и его роль в фармакологических исследованиях.
От 700 руб

