К настоящему времени описано более 200 аминокислот, обнаруженных в живых организмах. Их поделили на две группы: протеиногенные (обнаруженные в белках) или стандартные и непротеиногенные (небелковые). Основное количество аминокислот, не входящих в состав белков, выделено из растений и микроорганизмов.
Протеиногенные аминокислоты имеют тривиальное и рациональное название, трехбуквенное обозначение и три классификации. Наиболее рациональная классификация делит a-аминокислоты по полярности R-групп и их способности к взаимодействию с водой (при рН близкой к 7) на четыре группы:
I. Аминокислоты с неполярными, гидрофобными (водоотталкивающими) радикалами, их восемь:
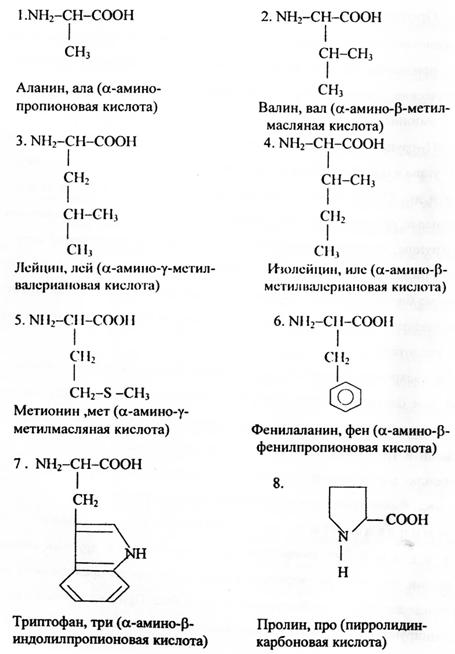 |
Радикалы рассмотренных 8-и аминокислот разной формы, величины и объема, играют важную роль в формировании третичной и четвертичной структур молекул белка и их стабилизации силами гидрофобного взаимодействия, т.к. молекулы воды, образуя между собой водородные связи, выталкивают гидрофобные группы, заставляют их собираться внутри структуры и уплотняться. Часть радикалов может располагаться снаружи молекулы, образуя гидрофобные зоны или участки, за счет которых белки взаимодействуют между собой и с другими гидрофобными соединениями, например, липидами.
II. Аминокислоты с полярными (гидрофильными) незаряженными радикалами, их семь:
1. NH2-CH-COOH 2. NH2-CH-COOH
½ ½
Н СН2
Глицин, гли (аминоуксус- ½
ная кислота) ОН
Серин, сер (a-амино-b-гидрокси-
пропионовая кислота)
3. NH2-CH-COOH 4. NH2-CH-COOH
½ ½
СН2 СН-ОН
½ ½
SH СН3
Цистеин, цис (a-амино-b- Треонин, тре (a-амино-b-гидрокси-
тиопропионовая кислота) масляная кислота)
5. NH2-CH-COOH 6. NH2-CH-COOH
½ ½
СН2 СН2
![]()
![]() ô ½
ô ½
![]()
![]()
![]() С=О
С=О
![]()
![]() ½
½
½ NH2
ОН
Тирозин, тир (a-амино-b-пара- Аспарагин, асн (b-амид аспараги-
гидроксифенилпропионовая новой кислоты, или полуамид a-
кислота) аминоянтарной кислоты)
7. NH2-CH-COOH
½
(СН2)2
½
С=О
ç
NH2
Глутамин, глн (g-амид глутаминовой
кислоты, или полуамид a-аминоглута-
ровой кислоты).
Полярность сер, тре, тир обусловлена их гидроксильными (-ОН) группами, полярность асн и глн - их амидными группами, полярность цис - его сульфгидрильной (тиоловой) группой. Цистеин заслуживает особого внимания, т.к. его сульфгидрильные группы сближаясь могут окисляться с образованем дисульфидной (-S-S-) связи (-SH+HS-®-S-S-+2H), которая участвует в формировании первичной и стабилизации третичной структуры белка.
Полярные незаряженные R-группы остатков аминокислот, сближаясь, при формировании третичной и четвертичной структур белка, образуют внутримолекулярные водородные связи (=CO××H-N=,=CО××HO- и т.д.) оставаясь свободными, они образуют водородные связи с другими органическими и неорганическими молекулами, в том числе и воды.
 |
III. Аминокислоты с полярными, отрицательно заряженными (кислыми) радикалами, их две:
Эти аминокислоты содержат вторую карбоксильную, отрицательно заряженную (кислую) группу, которая реагирует на изменения рН среды как и a-СООН группа. R-COO- группы асп и глу кислот (как свободных, так и в составе молекул белков) способны амидироваться с образованием асн и глн. Это свойство кислых аминокислот имеет большое значение в обезвреживании аммиака и обмене азота у всех организмов.
IV. Аминокислоты с полярными, положительно заряженными (основными) радикалами, их три:
|
½ (СН2)4 ½ NH2 Лизин, лиз (a,e-диамино- капроновая кислота) |
2. NH2-CH-COOH ½ (СН2)3 ½ NH Гуанидиновая ½ группа C = NH ½ NH2 Аргинин, арг (a-амино-d- гуанидинвалериановая кислота) |
3. NH2-CH-COOH ½ СН2 ô Имидазоль- ная группа NH N
Гистидин, гис (a-амино-b-имидазолпропионовая кислота) |
Положительный заряд радикалов обусловлен способностью к протонированию e-NH2 группы лиз, гуанидиновой и имидозольной групп арг и гис.
Отрицательно и положительно заряженные R-группы аминокислот обуславливают амфотерность молекул белка, сближаясь, при формировании третичной и четвертичной структур, образуют ионные (солевые) связи. Оставаясь свободными и в избытке они образуют ионные связи с другими органическими и неорганическими веществами, обуславливают кислые или основные свойства, суммарный заряд и гидрофильность молекул белка.
Методы обнаружения, разделения и количественного определения стандартных аминокислот основаны на их физико-химических свойствах.
Более ранняя классификация делит аминокислоты по строению на две группы: ациклические (алифатические) и циклические. В ациклических аминокислотах выделяют три подгруппы: 1) моноаминомонокарбоновые (нейтральные): гли, ала, сер, цис, мет, тре, вал, лей, иле; 2) моноаминодикарбоновые (кислые): асп, глу и их амиды - асн и глн; 3) диаминомонокарбоновые (основные): лиз, арг. Циклические аминокислоты: фен, тир, три, гис, про. Пролин является иминокислотой, т.к. его a-NH2 группа замещена частью радикала.
Некоторые авторы выделяют группу гидроксиаминокислот: сер, тре, тир; группу аминокислот содержащих серу - цис, мет и группу ароматических аминокислот (содержащих в радикале бензольное кольцо) - фен, тир и три.
Третья классификация основана на способности организмов синтезировать протеиногеные аминокислоты. Высшие растения, фото- и хемосинтезирующие микроорганизмы могут синтезировать все необходимые им аминокислоты. Человек и животные, например, синтезируют только 10 аминокислот, необходимых для биосинтеза белков. Эти аминокислоты называются заменимыми, другие 10 аминокислот: вал, лей, иле, три, мет, тре, фен, лиз, арг, гис не синтезируются и следовательно должны поступать в организм с пищей, их называют жизненно необходимыми или незаменимыми. Пищевые белки, содержащие все незаменимые аминокислоты называют полноценными. Это главным образом белки животного происхождения: мяса, рыбы, молока, яиц; из растительных - белки сои, риса, картофеля и др. Белки не содержащие хотя бы одну незаменимую аминокислоту, называют неполноценными, это главным образом белки растительного происхождения и некоторые белки животных, например, коллагены, эластины, кератины и др.
В питании есть понятие "биологическая ценность белков", которое включает аминокислотный состав белка, его переваримость и усвояемость аминокислот. За эталон биологической ценности (100 %) приняты белки молока и яиц, которые содержат незаменимые аминокислоты в достаточном количестве и оптимальных соотношениях для организма человека. Биологическая ценность белков мясных и рыбных продуктов составляет 90-95 %, картофеля - 85, бобовых культур - 75-85, пшеницы и ячменя -60-70 %. Низкая ценность белков растительного происхождения связана с крайне недостаточным содержанием в них лиз, мет, три, тре и других незаменимых аминокислот.
Поможем написать любую работу на аналогичную тему



 1. NH2-CH-COOH
1. NH2-CH-COOH