Существует три вида двойных жидких систем:
1 вид: жидкости не смешивающиеся ( не растворимые друг в друге)
Например: масло + вода.
Бензол + вода
Диэтиловый эфир + вода ( втирается для наркоза)
После их смешивания происходит их расслоение на 2 фазы ( тяжёлая в низу, лёгкая в верху и между ними граница раздела.)
Такие жидкости испаряются независимо друг от друга.
Парциальное давление пара каждой жидкости равно давлению её пара в чистом состоянии
Р1 = Р01
Р01 – жидкость в чистом виде
Р1 – парциальное давление
Р2 = Р02
Р = Р1 + Р2 по закону Дальтона.
Р = Р01 + Р02 для несмешивающихся жидкостей.
Общее давление пара над системой из двух не смешивающихся жидкостей равно сумме давлений пара этих жидкостей в чистом виде.
Отношение количества паров первой жидкости к количеству пара второй жидкости равно отношению их парциальных давлений: n1/ n2 = Р01/ Р02 Этот закон используется для перегонки органической жидкости в струе водяного пара.
Из формулы Р = Р01 + Р02 , следует что общее давление, равно сумме, следовательно оно больше, чем каждое давление, поэтому давление паров над смесью быстрее достигает величины атмосферного давления, и смесь закипает раньше, чем любая жидкость.
2 вид: Жидкости неограниченно растворимые друг в друге (смешиваются в любых соотношениях и образуют однородный раствор ( истинный))
Например: спирт + вода
Бывают двух видов:
- идеальные
- реальные
3 вид: Жидкости ограничено растворимые друг в друге ( можно смешать, но в определённых соотношениях)
После перемешивания расслаиваются, видна граница раздела между двумя фазами, такое расслаивание называется ликвация. В каждом слое присутствуют обе жидкости. В одном слое преобладает одна жидкость с небольшой примесью другой, а в другом слое другая жидкость с небольшой примесью первой жидкости.
Анилин + вода
Никотин + вода.
Идеальные Растворы образуют две жидкости, молекулы которых сходны по химическому составу, строению и по свойствам.
Хлорбензол + бромбензол
Жидкий азот и жидкий кислород : при смешивании таких двух жидкостей
V(смеси) = V1 + V2
При образовании раствора, теплового эффекта не наблюдается. Давление пара подчиняется закону Рауля Pi = P0i * Xi
Парциальное давление пара жидкости над идеальным раствором прямопропорциональна мольной доле этой жидкости в растворе.
Р1 = Р01 * Х1 для идеального раствора
Р2 = Р02 * Х2 для идеального раствора
Х1 = n1 / n1 + n2
Х2 = n2 / n1 + n2 ( может выражаться в %)
Р = Р1 + Р2
Р = Р01 * Х1 + Р02 * Х2 ( по этой формуле рассчитывается общее давление пара над идеальным раствором)
n1 / n2 = Р01 * Х1 / Р02 * Х2 Эта формула определяет состав пара над идеальным раствором.
n1 - число молей 1-й жидкости в парах.
n2 – число молей 2-й жидкости в парах.
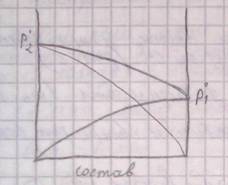
Диаграмма состояния идеального раствора ( зависимость давления пара от состава жидкой смеси)

По диаграммам можно определить давление пара каждой жидкости и общее давление при заданном составе жидкой смеси.
Реальные растворы образуют две жидкости, молекулы которых отличаются по составу, строению и свойствам.
В свою очередь реальные растворы делятся на 2 вида:
- С положительным отклонением от линейной зависимости ( от закона Рауля)
- С отрицательным отклонением от линейной зависимости.
ü Fразн. > Fодин. F – сила взаимодействия между молекулами.
Vсмеси < V1 + V2
Процесс с выделением теплоты ( Q>0 экзо-) дельто Н <0 испарения меньше, следовательно давление пара меньше, чем над идеальным раствором.
Отрицательное отклонение от линейной зависимости и диаграмма с вогнутыми линиями.
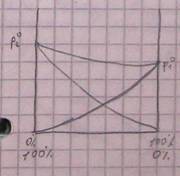 Закон Рауля таким смесям не подчиняется.
Закон Рауля таким смесям не подчиняется.
ü Fразн. < Fодин
Vсмеси > V1 + V2
Теплота поглощается, испарение усиливается, следовательно паров становится больше => давление пара увеличивается => положительное отклонение от линейной зависимости или от закона Рауля.
Р1 = Р01 * Х1 Закон Рауля для идеального раствора.
Формулировка: Давление насыщенного пара над раствором оказывается меньше, чем на чистым раствором.
Или
Давление над раствором насыщенного пара какого-либо компонента пропорционально молярной доле этого компонента в растворе.
Поможем написать любую работу на аналогичную тему
Реферат
Двойные жидкие системы. Идеальные и реальные растворы. Закон Рауля для идеального раствора.
От 250 руб
Контрольная работа
Двойные жидкие системы. Идеальные и реальные растворы. Закон Рауля для идеального раствора.
От 250 руб
Курсовая работа
Двойные жидкие системы. Идеальные и реальные растворы. Закон Рауля для идеального раствора.
От 700 руб

