Буферными растворами называются растворы с устойчивой концентрацией водородных ионов и, следовательно, с определенным значением рН, почти не зависящим от разведения и лишь слабо изменяющимся при прибавлении к раствору небольших количеств сильной кислоты или щелочи.
Такими свойствами обладают растворы, содержащие слабую кислоту или слабое основание совместно с их солью. Рассмотрим для примера раствор, содержащий уксусную кислоту и ацетат натрия. В этом случае процесс диссоциации характеризуется уравнением
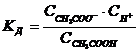 . (7.18)
. (7.18)
Присутствие ацетата практически полностью подавляет диссоциацию самой кислоты. Поэтому можно считать, что концентрация ССН3СООН практически равна исходной концентрации кислоты Ск. Концентрация ацетата равна концентрации a х Ссоли, т.е. произведению концентрации соли на степень ее диссоциации. В результате получим
![]() . (7.19)
. (7.19)
Для разбавленных растворов a = 1.
Тогда рН буфера будет:
![]() , (7.20)
, (7.20)
или
![]() , (7.21)
, (7.21)
или
![]() . (7.22)
. (7.22)
Для основных буферов:
![]() (7.23)
(7.23)
Величина рН – буферных растворов зависит:
от показателя константы диссоциации слабой кислоты или слабого основания;
от соотношения компонентов буферного раствора.
DрН = рК + 1 – зона буферного действия раствора.
В этом интервале значений рН наиболее четко поддерживается активная кислотность среды.
Поможем написать любую работу на аналогичную тему

