Для идеальных газов уравнение Клапейрона: ![]() . Для реальных газов оно соблюдается лишь приближенно. Отступления от идеальной модели связаны с наличием жидкого и твердого состояний и наличием межмолекулярного взаимодействия.
. Для реальных газов оно соблюдается лишь приближенно. Отступления от идеальной модели связаны с наличием жидкого и твердого состояний и наличием межмолекулярного взаимодействия.
Потенциал взаимодействия (Леннарда-Джонса): ![]() .
.
Здесь ![]() – константы,
– константы, ![]() – расстояние между центрами взаимодействующих частиц. Этот потенциал с хорошей точностью описывает реальный газ. На рисунке 1
– расстояние между центрами взаимодействующих частиц. Этот потенциал с хорошей точностью описывает реальный газ. На рисунке 1 ![]() – диаметр молекулы. Рассматриваемая модель газа: твердые упруго сталкивающиеся шары, причем возможны только парные столкновения (это выполняется довольно точно при небольших давлениях газа).
– диаметр молекулы. Рассматриваемая модель газа: твердые упруго сталкивающиеся шары, причем возможны только парные столкновения (это выполняется довольно точно при небольших давлениях газа).
Уравнение Ван-дер-Ваальса ![]() ,
,
где ![]() – универсальная газовая постоянная,
– универсальная газовая постоянная, ![]() – давление,
– давление, ![]() – объем,
– объем, ![]() – температура,
– температура, ![]() – поправка на то, что отдельно взятой молекуле предоставлен не весь объем
– поправка на то, что отдельно взятой молекуле предоставлен не весь объем ![]() , т.к. молекулы не могут сблизиться на расстояние, меньшее
, т.к. молекулы не могут сблизиться на расстояние, меньшее ![]() ;
; ![]() – поправка на то, что на пристеночный слой газа действует сила со стороны всего газа, стремящаяся втянуть внутрь газа пристеночный слой.
– поправка на то, что на пристеночный слой газа действует сила со стороны всего газа, стремящаяся втянуть внутрь газа пристеночный слой.
![]() – так называемое внутреннее давление.
– так называемое внутреннее давление.
![]() или
или ![]() ,
,
где ![]() – концентрация,
– концентрация, ![]() – масса частицы,
– масса частицы, ![]() – скорость частицы. Для
– скорость частицы. Для ![]() можно получить:
можно получить:
![]() .
.
Теоретический вывод уравнения Ван-Дер-Ваальса применим при условях:
![]() .
.
В случае плотных газов уравнение Ван-Дер-Ваальса лишь качественно описывает поведение газа. Для реальных газов ![]() и
и ![]() зависят от температуры.
зависят от температуры.
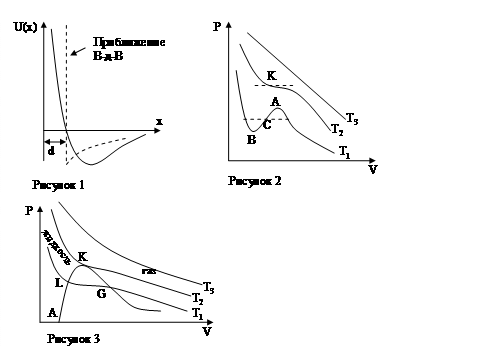
Изотермы Ван-Дер-Ваальса (рисунок 2).
![]() . Здесь при
. Здесь при ![]() наблюдается критическая изотерма, т.е. при
наблюдается критическая изотерма, т.е. при ![]() уравнение изотермы имеет один корень при
уравнение изотермы имеет один корень при ![]() . Точка
. Точка ![]() называется критической.
называется критической.
![]() ,
, ![]() ,
, ![]() .
.
Уравнение изотермы:
![]()
Участки типа ВСА соответствуют неустойчивому состоянию вещества и практически не могут быть реализованы.
Изотермы реального газа (рисунок 3).
Область между кривой ALKG и изобарой ![]() соответствует двухфазным состояниям вещества, т.е. каждая точка этой области изображает такое состояние вещества, в котором оно не является физически однородным, а состоит из жидкости и ее насыщенного пара (за исключением случаев неустойчивого состояния в виде перегретой жидкости или пересыщенного пара).
соответствует двухфазным состояниям вещества, т.е. каждая точка этой области изображает такое состояние вещества, в котором оно не является физически однородным, а состоит из жидкости и ее насыщенного пара (за исключением случаев неустойчивого состояния в виде перегретой жидкости или пересыщенного пара).
Поможем написать любую работу на аналогичную тему

