1. Основные отличия между ДНК и РНК
2. Правила Чаргаффа
3. Строение нуклеиновых кислот. Принцип комплиментарности азотистых оснований.
4. Методы изучения нуклеиновых кислот
Нуклеиновая кислота – высокомолекулярное соединение или биологический полимер, построенный из мононуклеотидов. Различают два вида нуклеиновых кислот: 1) дезоксирибонуклеиновая кислота (ДНК) и 2) рибонуклеиновая кислота (РНК).
Биологическая функция нуклеиновых кислот заключается в хранении, передаче и реализации генетической информации, обеспечивая тем самым жизнедеятельность и индивидуальность живого организма.
Основные отличия между ДНК и РНК
1. ДНК имеет двухцепочечную структуру, РНК - одноцепочечна. ДНК локализована в основном ядре клетки, РНК – в цитоплазме. РНК бывает 3-х основных видов: иРНК, тРНК и рРНК.
2. Отличие в нуклеотидном составе: ДНК построена из АМФ, ГМФ, ЦМФ, ТМФ; РНК – из АМФ, ГМФ, ЦМФ и УМФ. Таким образом, в ДНК никогда не встречается УМФ, а в РНК – ТМФ,
3. Отличие в строении нуклеотидов: в нуклеотидах ДНК вторым, углеводистым компонентом является дезоксирибоза, в нуклеотидах РНК – рибоза.
Огромную роль в разгадке особенностей строения, в расшифровке структуры молекулы ДНК сыграло учение американского биохимика Эрвина Чаргаффа. Основные положения его учения известны как правила Чаргаффа.
Правила Чаргаффа
1. Нуклеотидная последовательность ДНК клеток тканей организмов одного и того же вида одинаковая, а нуклеотидная последовательность ДНК из клеток организмов различных видов различна.
2. Нуклеотидная последовательность ДНК не меняется с возрастом, не зависит от питания (кормления) и от изменений условий окружающей среды.
3. В молекуле ДНК количество адениловых остатков равно количеству тимидиловых, а количество гуаниловых – количеству цитидиловых (А=Т, Г=Ц).
4. В молекуле ДНК сумма пуриновых оснований равна сумме пиримидиновых оснований (А+Г=Ц+Т).
Строение нуклеиновых кислот.
Принцип комплиментарности
Известно, что структурными единицами нуклеиновых кислот являются – мононуклеотиды. Следовательно, нуклеиновые кислоты представляют собой полинуклеотиды. Мононуклеотиды в полинуклеотидной цепи связываются между собой сложноэфирной связью. Ковалентный остов молекулы нуклеиновой кислоты составляют монотонно чередующиеся остатки фосфорной кислоты и пентозы, а азотистые основания как боковые группы стоят на равных расстояниях друг от друга связанные пентозами.
Остаток фосфорной кислоты с одного конца цепи связывается 5 углеродом, с другого – 3 углеродом пентозы. В зависимости от этого различают -5/ конец и -3/ конец полинуклеотидной цепи.
-5/ -3/
![]()
![]()
![]()
![]()
| | |
азотистое азотистое азотистое
основание основание основание
Рис. 6. Схема строения цепи нуклеиновой кислоты.
Две цепи ДНК всегда обращены друг другу своими азотистыми основаниями. В такой структуре оказываются точно пригнанными друг другу только определенные пары азотистых оснований. Таковыми являются А-Т и Г-Ц пары. Они дополняют друг друга, они связаны между собой водородными связями, они – комплиментарны. В этом суть принципа комплиментарности.
Принцип комплиментарности является основным биологическим «законом» обеспечивающим хранение, передачу и реализацию генетической информации, обуславливая тем самым жизнедеятельность и индивидуальность живых организмов.
Методы изучения нуклеиновых кислот
Секвенирование нуклеиновых кислот.
Определение нуклеотидной последовательности нуклеиновых кислот принято называть секвенированием. Известны различные технологии секвенирования ДНК. Однако, в настоящее время нет ни одного метода секвенирования, который бы работал для молекулы ДНК целиком. Все они устроены так: сначала готовится большое число небольших участков ДНК (клонируется молекула ДНК многократно и «разрезается» её в случайных местах), а потом читается каждый участок по отдельности.
Среди большого многообразия методик наиболее известным является метод Сэнгера предложенный в 1977 г. и получивший название метода терминирующих аналогов трифосфатов. Этот способ, несколько модифицированный, и в более мощном, более технологичном варианте применяется до сих пор. В основе метода лежит ферментативное клонирование ДНК, используя в качестве праймеров синтетические олигонуклеотиды. Специфическую терминацию синтеза обеспечивает добавление в реакционную смесь помимо четырех типов нуклеозидтрифосфатов (один из которых радиоактивно мечен) и одного из 2',3'-дидезок-синуклеозидтрифосфатов, который способен включаться в растущую цепь ДНК, но не способен обеспечивать дальнейшее копирование из-за отсутствия 3'-ОН группы. В итоге удается получить набор копий ДНК различной длины. Для определения первичной структуры исследуемого фрагмента ДНК необходимо провести четыре реакции копирования: по одному типу терминаторов в каждой из реакций. После этого полученные продукты подвергаются электрофорезу в полиакриламидном геле на соседних дорожках и по расположению полос определяется последовательность нуклеотидов.
Современные секвенаторы – это так называемые секвенаторы второго поколения (SGS, second generation sequencing). В них участки ДНК также по-прежнему многократно клонируются, но процесс чтения устроен не так, как у Сэнгера. Существует много разных методов, отличающихся довольно существенно.
1) Секвенирование лигированием (sequencing by ligation) - на фазе распознавания нуклеотидов используют не ДНК-полимеразу и процесс репликации, а специальные короткие «зонды», которые присоединяются к комплементарным нуклеотидам, фиксируются, затем вымываются, и процесс повторяется снова.
2) Пиросеквенирование (pyrosequencing) - основано на хемилюминесцентных сигналах, которые подают специально модифицированные нуклеотиды, когда соединяются с комплементарным нуклеотидом в прочитываемой нити ДНК.
3) Метод ионного полупроводникового секвенирования - детектирует соединения (ионы), которые выделяются при присоединении нового нуклеотида к нити ДНК.
Рестрикционный анализ.
Метод основан на способности ферментов рестрикции (рестриктазы) специфически расщеплять ДНК в определённых сайтах.
Рестриктазы стали эффективным инструментом исследования нуклеиновых кислот. Они позволяют превращать молекулы ДНК в набор фрагментов длиной от нескольких сотен до нескольких тысяч оснований. Методом электрофореза в агарозном геле фрагментов ДНК, различающиеся по размеру, можно легко разделить, а затем исследовать каждого по отдельности. При электрофорезе короткие фрагменты мигрируют намного быстрее, чем длинные. При окрашивании гелей красителями, связывающимися с ДНК, выявляется набор полос, каждая из которых отвечает рестрикционному фрагменту.
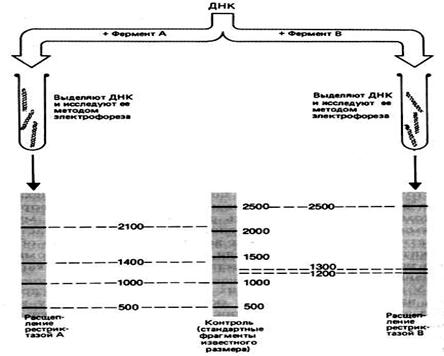
Рис. 7. Результаты электрофореза после обработки фрагмента ДНК разными рестриктазами.
Сравнение размеров фрагментов ДНК, полученных после обработки определенного участка генома набором рестриктаз, позволяет построить рестрикционную карту, на которой указано положение каждого сайта рестрикции относительно других участков.
Полимеразная цепная реакция.
Полимеразная цепная реакция (ПЦР) — экспериментальный метод молекулярной биологии, способ значительного увеличения малых концентраций определённых фрагментов ДНК (клонирование) в биологическом материале.
Метод ПЦР относится к гибридизационным методам анализа ДНК, основанным на достраивании комплементарной полинуклеотидной цепи на одинарной полинуклеотидной цепи - матрице. Принцип метода ПЦР был разработан в начале 80-ых годов прошлого столетия в США. В настоящее время метод широко используется в научных исследованиях, в практическом здравоохранении и службе Госсанэпиднадзора.
Основные стадии ПЦР
1) денатурация ДНК (расплетение двойной спирали, расхождение нитей ДНК) при 94—96 °C.
2)отжиг при 68 °C, образование коротких двухцепочечных участков ДНК (затравок, необходимых для инициации синтеза ДНК) или связывание нитей ДНК праймерами;
3) элонгация при 72 °C или синтез новой цепи ДНК (комплементарное достраивание обеих нитей);
4) окончание первого цикла. Две получившиеся ДНК-цепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается.

Рис.8.Схематическое изображение первого цикла ПЦР.
Таким образом, в основе метода ПЦР лежит многократное удвоение определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). В результате нарабатывается количество ДНК, достаточное для визуальной детекции.
Кроме простого увеличения числа копий ДНК (этот процесс называется амплификацией), ПЦР позволяет производить множество других манипуляций с генетическим материалом. Широко используется в биологической и медицинской практике, например, для диагностики заболеваний (наследственных, инфекционных), для установления отцовства, для клонирования генов, введения мутаций, выделения новых генов.
Методы гибридизации.
Гибридизация ДНК, гибридизация нуклеиновых кислот - соединение in vitro комплементарных одноцепочечных нуклеиновых кислот из разных источников в одну молекулу.
В 1961 году было обнаружено, что если комплементарные цепи ДНК, полученные после денатурации, выдержать при температуре 65°С, они легко спариваются, восстанавливая структуру двойной спирали (ренатурация). Подобные процессы могут происходить между двумя любыми одинарными цепями нуклеиновых кислот (ДНК—ДНК, РНК—РНК, ДНК—РНК) при условии, что они содержат комплиментарные последовательности нуклеотидов.
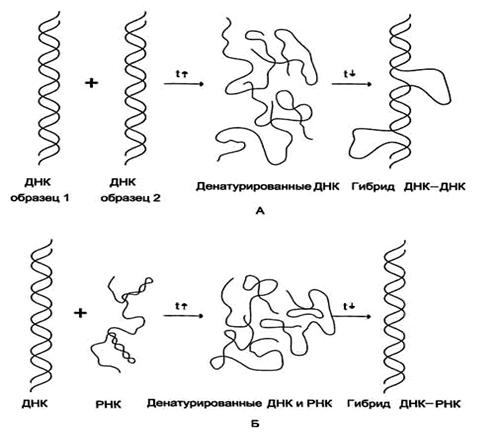
Рис. 9. Способы гибридизации
Этот метод весьма эффективен для поиска неидентичных, но родственных генов. Например, после клонирования интересующих исследователя генов, их последовательности могут быть использованы для поиска соответствующих генов в геноме человека. Участки ДНК (РНК) с известной последовательностью нуклеотидов, меченые специальной меткой и используемые для гибридизации называются ДНК (РНК)-зондами.
ДНК-зонды применяются в различных целях. Гибридизация ДНК-зонда с РНК, выделенной из анализируемой клетки, может выявить наличие или отсутствие экспрессии гена. Если гибридизации не происходит, значит, ген молчит, не работает. ДНК-зонды также позволяют проводить диагностику инфекционных и наследственных болезней. Методы гибридизации лежат в основе других более современных методов изучения нуклеиновых кислот.
Поможем написать любую работу на аналогичную тему

