1. Классификация ферментов.
2. Свойства ферментов.
3. Механизм действия ферментов.
4. Определение активности ферментов.
5. Иммобилизованные ферменты.
Ферменты представляют собой высокоспециализированный класс веществ белковой природы, используемых живыми организмами для осуществления многих тысяч взаимосвязанных химических реакций, совокупность которых составляет сущность обмена веществ. Ферменты – биологические катализаторы, функциональные единицы клеточного метаболизма. Действуя в строго определенной последовательности, они катализируют сотни многостадийных реакций, в ходе которых расщепляются молекулы питательных веществ, запасается и преобразуется химическая энергия, из простых молекул-предшественников строятся макромолекулы, входящие в состав клетки. Подсчитано, что живая клетка может содержать до 3000 различных ферментов, каждый из которых ускоряет ту или иную химическую реакцию, т.е. выполняет функцию биологических катализаторов. Подобно неорганическим катализаторам, ферменты повышают скорость химических реакций за счет понижения энергии активации. Как и катализаторы неорганической природы, они не вызывают каких-либо химических реакций, а лишь ускоряют существующие и неизменны после реакции. Однако, биологические катализаторы по ряду признаков резко отличаются от неорганических катализаторов.
Свойства ферментов
Первое различие состоит в том, что ферменты «работают» в очень мягких условиях и проявляют чрезвычайно высокую каталитическую активность. Так, например, гидролитический распад белка до аминокислот в присутствии неорганических катализаторов (кислот или щелочей) осуществляется при температуре 1000С и выше за несколько часов. Этот же процесс при каталитическом участии специфических ферментов требует всего нескольких минут и происходит при температуре 30-400С. Принято считать, что неорганический катализатор может ускорить химические реакции до 103, фермент – до 1020 раз.
Второе различие заключается в том, что ферменты обладают необыкновенно высокой специфичностью действия. Каждый фермент катализирует, как правило, одну единственную химическую реакцию. Один фермент – одна реакция. Тем не менее, по специфичности ферменты подразделяются на 2 вида: 1) ферменты с абсолютной специфичностью и 2) ферменты с относительной или групповой специфичностью.
Для ферментов с относительной специфичностью субстратом является группа атомов в молекуле или связь. Например, пепсин. Субстратом для него является пептидная группировка атомов или пептидная связь. Пепсин расщепляет, как известно, белки, т.е. те молекулы, в которых присутствует пептидная группировка.
Для ферментов с абсолютной специфичностью субстратом является сама молекула, вступающего в химическую реакцию вещества. Большинство ферментов обладают абсолютной специфичностью.
Один из важных различий между неорганическими катализаторами и ферментами связан с белковой природой последних. Ферменты проявляют свою активность только в условиях водных растворов и при физиологических значениях рН и температуры среды.
Классификация и номенклатура ферментов
По строению ферменты могут быть простыми и сложными белками. Небелковую часть сложного фермента, которая легко может отделяться от апофермента (белковая часть фермента) и которая, как правило, представлена сложными органическими соединениями, называют коферментом.

Рис. 12. Строение сложного белка-фермента.
Небелковая часть фермента может быть представлена и простыми веществами неорганической природы, чаще ионами металлов, которые оказываются прочно связанными с апоферментом. В этом случае её называют - кофермент.
Из большого числа ферментов можно выделить особый класс - регуляторные ферменты, которые могут воспринимать различные метаболические сигналы и в соответствии с ними изменять свою каталитическую активность. Благодаря действию таких ферментов все ферментативные системы в клетке функционируют координированно, что является необходимым для поддержания жизнеспособности отдельных клеток и целых организмов.
Различают несколько групп регуляторных ферментов. Наибольшее значение из них имеет аллостерические ферменты, которые кроме активного центра содержат ещё второй центр, называемый аллостерическим. Аллостерический центр - это участок молекулы фермента служащий для присоединения определенного низкомолекулярного вещества – медиатора. Медиаторы бывают двух видов: активаторы и ингибиторы, которые вызывают изменение конфигурации активного центра и соответственно, либо увеличение, либо снижение каталитической активности фермента.
В настоящее время известно около 5000 различных ферментов. Согласно международной системе классификации и номенклатуры различают 6 классов ферментов. Каждый класс подразделяется на подклассы, а подклассы на группы.
1. Оксидоредуктазы - катализируют окислительно - восстановительные реакции.
2. Трансферазы - катализируют реакции переноса функциональных групп и остатков молекул.
3. Гидролазы - катализируют реакции гидролиза.
4. Лиазы - катализируют негидролитическое расщепление связей образованных с участием углерода.
5. Изомеразы - катализируют реакции изомеризации.
6. Лигазы (синтетазы) - катализируют реакции синтеза или образования новых связей.
По международной системе классификации оксидоредуктазы подразделяются на 23 подкласса, трансферазы – на 10, гидролазы – на 13 и т.д. В таблице 1 представлены названия некоторых подклассов оксидоредуктаз взятых с сайта NC-IUBMB (Nomenclature Committee of the
International Union of Biochemistry and Molecular Biology)
Таблица 1. Оксидоредуктазы.
|
EC 1. Oxidoreductases |
|
EC 1.1. Acting on the CH-OH group of donors EC 1.2. Acting on the aldehyde or oxo group of donors EC 1.3. Acting on the CH-CH group of donors EC 1.4. Acting on the CH-NH2 group of donors EC 1.5. Acting on the CH-NH group of donors EC 1.6. Acting on NADH or NADPH EC 1.7. Acting on other nitrogenous compounds as donors EC 1.8. Acting on a sulfur group of donors EC 1.9. Acting on a heme group of donors EC 1.10. Acting on diphenols and related substances as donors EC 1.1 1. Acting on a peroxide as acceptor EC 1.1 2. Acting on hydrogen as donor • Other oxidoreductases |
Системные названия ферментов указывают на тип катализируемой реакции, на характер субстрата и продукта реакции. Очень часто эти названия бывают длинными и в связи с этим неудобными для использования. Международная система классификации и номенклатуры ферментов предполагает присвоение каждому ферменту кодового номера (шифр) из четырехзначной цифры. Первая цифра кода указывает на класс, вторая – на подкласс, третья – на группу, а четвертая – порядковый номер фермента в группе.
Механизм действия ферментов
Первым шагом в механизме действия ферментов всегда является связывание фермента со своим специфичным субстратом и образование фермент-субстратного комплекса.
Образование фермент-субстратного комплекса сопряжено с наличием в его молекуле особых участков, ответственных за связывание субстрата и за непосредственный контакт с ним - активные центры. Это уникальное сочетание аминокислотных остатков, располагающихся в определенной части белковой молекулы, сюда же входят и небелковые компоненты фермента.
Фермент – субстратный комплекс всегда распадается на свободный фермент и продукты реакции.
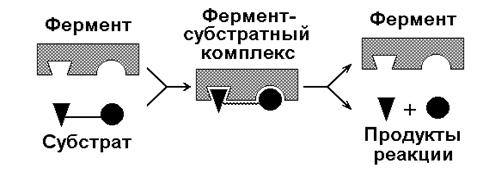
Рис. 13. Схема механизма действия фермента.
Механизм действия ферментов может быть рассмотрен с двух позиций: с точки зрения событий в активном центре и изменения энергетики химических реакций.
С энергетической точки зрения ферменты обеспечивают высокую скорость реакций при оптимальных условиях, существующих в клетке, путём понижения уровня энергии активации (рис.14). Ферменты снижают высоту энергетического барьера, в результате возрастает количество реакционно-способных молекул, следовательно, увеличивается скорость реакции.
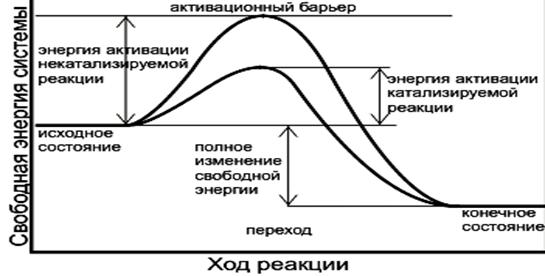
Рис. 14. Схема механизма действия фермента по изменению энергетики катализируемой реакции.
Активный центр на всех этапах ферментативного катализа нельзя рассматривать как пассивный участок для связывания субстрата. Это комплексная молекулярная "машина", использующая разнообразные химические механизмы, способствующие превращению субстрата в продукт.
В активном центре фермента субстраты располагаются так, чтобы участвующие в реакции функциональные группы субстратов находились в непосредственной близости друг к другу. Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание химической реакции и образование продуктов.
Механизмы ферментативного катализа определяются ролью функциональных групп активного центра фермента в химической реакции превращения субстрата в продукт. Выделяют 2 основных механизма ферментативного катализа: кислотно-основной катализ и ковалентный катализ.
Кроме активного центра, некоторые ферменты имеют дополнительный, регуляторный или аллостерический (allos – другой, steros – пространственный) центр, с которым взаимодействуют аллостерические регуляторы или модуляторы (активаторы и ингибиторы). Аллостерические ферменты подразделяются на две группы: 1) гомотропные 2) гетеротропные.
Гомотропные ферменты активизируются своими же субстратами, т.е. у них субстрат и активатор одно и то же вещество. Активный центр одновременно может выполнять функции аллостерического.
Изучение аллостерической регуляции активности ферментов, особенно процессов ингибирования, имеют большое практическое значение. Оно позволяет определять последовательность реакций в сложных многоступенчатых биохимических процессах, выявлять изоформы различных ферментов. Кроме того, различные ингибиторы ферментов широко применяются в медицинской практике как терапевтические средства при патологиях инфекционной и незаразной этиологии.
Определение активности ферментов
Одним из направлений энзимологии является энзимодиагностика, которая развивается, во-первых, по пути применения высокоочищенных ферментов в качестве избирательных реагентов для открытия и количественного определения с диагностической целью химических веществ в биологических жидкостях, во-вторых, по пути обнаружения и определения активности самих ферментов в различных тканях.
Для диагностики различных патологических процессов в организме широко используются ферментные тесты, отличающиеся от других химических диагностических тестов высокой чувствительностью и специфичностью.
В настоящее время известно множество различных тестов, основанных на количественном определении активности ферментов в различных тканях и биологических жидкостях. При диагностике различных заболеваний используют показатели активности десятков ферментов и их изоферментов. В клинической практике часто определяют активность аспартатаминотрансферазы, аланинаминотрансферазы, лактатдегидрогеназы, аргиназы, алкоголдегидрогеназы, цитохромоксидазы, амилазы и др.
В основе всякого количественного определения ферментативного действия или активности действия фермента находятся изменения, которые происходят с субстратом соответствующей ферментативной реакции.
Наиболее часто активность действия ферментов выражается количеством вещества, которое за строго определенное время и в строго определенных условиях подвергалось тому или иному изменению. Ферментативное действие может быть оценено также временем, необходимым для строго определенного изменения субстрата.
Согласно заключения Комиссии по ферментам Международного биохимического союза, единица активности (Е) фермента – это количество фермента, которое катализирует превращение одного микромоля субстрата за 1 мин при стандартных условиях.
Иммобилизованные ферменты
Иммобилизованные ферменты (от лат. immobiiis - неподвижный), препараты ферментов, молекулы которых связаны с твердой матрицей, или носителем (как правило, полимером), сохраняя при этом полностью или частично свои каталитические свойства.
В конце 60-х – начале 70-х гг. на базе технической биохимии, химической энзимологии и ряда инженерных дисциплин возникло новое научно-техническое направление биотехнологии – инженерная энзимология, к которой относят систему методов получения, очистки, стабилизации и применения ферментов.
Ферменты в качестве биологических катализаторов применяются в различных отраслях промышленности - пищевой, текстильной, фармацевтической, кожевенной, в медицине, сельском хозяйстве, в тонком органическом синтезе и т.д. Более широкое использование ферментов в биотехнологии до последнего времени сдерживалось вследствие ряда причин, а именно: трудоемкости отделения ферментов от исходных реагентов и продуктов реакции; нестабильности ферментов при хранении и при действии различных факторов; высокой стоимости чистых ферментных препаратов.
Создание биокатализаторов нового поколения - иммобилизованных, т.е. связанных ферментов открыло перед прикладной энзимологией новые перспективы.
Иммобилизованные ферменты имеют существенные преимущества. Так, например, они легко отделимы от реакционной среды. Иммобилизованные ферменты технологичны, что определяется возможностью вести биотехнологический процесс непрерывно и регулировать скорость катализируемой реакции. Подбором соответствующих носителей и методов иммобилизации можно целенаправленно модифицировать такие свойства ферментов, как специфичность, зависимость активности от рН и температуры среды и др.
Иммобилизованные ферменты можно использовать, главным образом, в трех основных направлениях:
1. Аналитическое исследование различных химических и биологических веществ, как в живом организме, так и в объектах окружающей среды.
2. Лечебные средства
3. Применение в различных производствах.
Поможем написать любую работу на аналогичную тему

