1. Строение и классификация аминокислот. Заменимые и незаменимые аминокислоты.
2. Свойства аминокислот и белков. Кислотно-основные свойства.
3. Структура белковой молекулы. Механизм образования пептидной связи.
4. Функции и уровни структурной организации белков.
5. Классификация белков.
Молекулярную основу живой клетки составляют различные биомолекулы – белки, липиды, полисахариды. Среди огромного разнообразия биомолекул различают несколько видов, так называемых, первичных, которые представляют собой простые молекулы-предшественники, поступающие из окружающей среды. Связываясь ковалентно друг с другом, они образуют макромолекулы клетки. Макромолекулы при помощи нековалентных связей объединяются в надмолекулярные комплексы и в конечном итоге образуют клеточные органеллы.
Предполагается, что первые клетки могли образоваться из небольшого количества первичных биомолекул, в том числе глицерина и холина, пуриновых и пиримидиновых оснований, жирных кислот, глюкозы и аминокислот. От этих биомолекул происходят сотни других, выполняющих более специализированные и обособленные функции у различных организмов.
Аминокислоты
Аминокисло́ты(аминокарбо́новые кисло́ты) — органи-ческие соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в углеводородном радикале которых один или несколько атомов водорода заменены на аминные группы.
В природе известны более 200 различных аминокислот. В животном организме обнаруживаются около 120 из них, выполняющие различные биологические функции. В живой природе наибольшее значение имеют 20 (по уточненным данным 21) a-аминокислот, известные, как белковые.
Аминокислота – структурная единица белка.
Все белки живой природы построены из остатков 21 a-аминокислоты. a-Аминокислоты содержат у одного и того же атома углерода (a-углеродного атома) аминогруппу и карбоксильную группу и их можно выразить единой схематичной формулой:
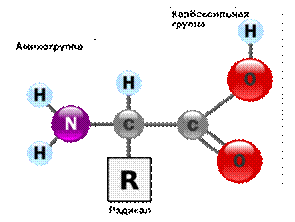
Рис.1.Общая схематичная
формула белковой
аминокислоты
Номенклатура и классификация аминокислот
Каждая аминокислота содержит характерную только для неё R-группу, благодаря чему обладает химической индивидуальностью. R-группы аминокислот служат «буквами» в молекулярном алфавите белковой структуры.
Белковые аминокислоты больше известны под тривиальными названиями. Они являются производными всего лишь нескольких карбоновых кислот: уксусной – 1 амнокислота, пропионовой – 8, масляной – 3, валериановой – 3, капроновой – 1, янтарной и глутаровой – по одной аминокислоте. Кроме того в перечень белковых аминокислот включают 2 иминокислоты – пролина и оксипролина. 21-й белковой аминокислотой является аминолимонная кислота, которая обнаруживается в белках некоторых микроорганизмов. В составе природных белков могут встречаться производные некоторых аминокислот: аспарагин и глутамин – амиды аспарагиновой и глутаминовой кислот соответственно, оксилизин.
В настоящее время известны разнообразные способы классификации аминокислот. В целом, все они основаны на различиях в природе их R-групп.
Ι. Один из последних способов основан на различиях в полярности R-групп. Согласно этой классификации различают четыре основных класса: 1) неполярные, или гидрофобные; 2) полярные, но незаряженные; 3) положительно заряженные; 4) отрицательно заряженные.
ΙΙ. По количеству карбокси- и аминогрупп. 1) Моноаминомонокарбоновые кислоты (глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, фенилаланин, тирозин, метионин, триптофан и т.д.); моноаминодикарбоновые кислоты (аспарагиновая кислота, глутаминовая кислота); диаминомонокарбоновые кислоты (лизин, аргинин).
ΙΙΙ. По биологическим (физиологическим) значениям аминокислоты подразделяют на две группы: 1) незаменимые, которые не могут синтезироваться в организме из других соединений и которые должны обязательно поступать из вне. 2) заменимые - аминокислоты, которые синтезируются в организме в достаточном количестве.
Биологическая классификация аминокислот не является универсальной и в определенной степени условна, так как зависит от вида организма. Условно выделяют 10 незаменимых аминокислот: валин, лейцин, изолейцин, треонин, метионин, триптофан, лизин, фенилаланин, аргинин и гистидин.
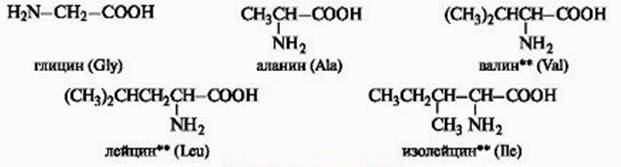 Моноаминомонокарбоновые аминокислоты
Моноаминомонокарбоновые аминокислоты
Оксиаминокислоты

 Серосодержащие аминокислоты
Серосодержащие аминокислоты
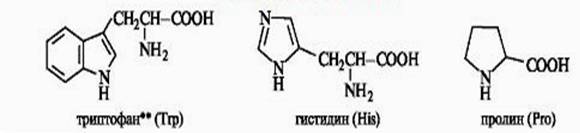
 Ароматические аминокислоты
Ароматические аминокислоты
Гетероциклические аминокислоты
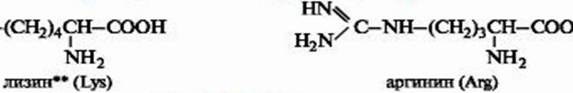 Диаминокарбоновые аминокислоты
Диаминокарбоновые аминокислоты
Моноаминодикарбоновые аминокислоты

Свойства аминокислот
Среди всех, физических и химических свойств аминокислот наибольшее значение в биологии имеют кислотно-основные свойства. Именно эти свойства аминокислот, во многом, определяют особенности физико-химического поведения и биологические функции белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации, как аминокислот, так и белков.
Аминокислоты, будучи органическими соединениями, содержащими одновременно карбоксильные и амин-ные группы, обладают амфотерными свойствами.
NH2 NH2![]() H+
H+
½ ½
R ¾ C ¾ COOH Û R ¾ C ¾ COO-
ç ç
H H
Аминокислоты легко растворимы в воде. Все α-аминокислоты при физиологических значениях рН в водных растворах существуют преимущественно в виде биполярных ионов.
Аминокислоты – амфотерные соединения.
В сильнокислой среде карбоксильная группа полностью недиссоциирована, а аминогруппа протонирована. Наоборот, в сильнощелочной среде аминогруппа находится в виде свободного основания, а карбоксильная группа – в виде карбоксилат-аниона.
Амфотерные свойства аминокислот влияют на кислотно-основные свойства белков и их биологические функции.
Белки
Белки – высокомолекулярные азотосодержащие соединения (биологические полимеры) построенные из остатков a-аминокислот, связанных между собой пептидной связью.
Белки являются основными носителями отличительных свойств живой природы, наиболее важной составной частью клеток всех животных тканей. Они выполняют в организме многочисленные жизненноважные функции. Обладая многоликими по химическим свойствам радикалами аминокислотных остатков, белковые молекулы в целом и отдельные их части способны вступать в разнообразные химические и физические взаимодействия как с друг с другом, так и с нуклеиновыми кислотами, полисахаридами, липидами и т.п., образуя надмолекулярные комплексы, составляющие основу субклеточных структур.
Кислотно - основные свойства белков.
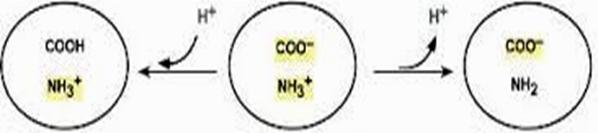 Кислотно-щелочные свойства белков главным образом связаны с катионообразующими (-NH3+) и анионобразующими (-СОО) группами. Схематично, поведение молекулы белка в зависимости от различных значений рН среды, можно представить так:
Кислотно-щелочные свойства белков главным образом связаны с катионообразующими (-NH3+) и анионобразующими (-СОО) группами. Схематично, поведение молекулы белка в зависимости от различных значений рН среды, можно представить так:
кислая среда нейтральная среда щелочная среда
Рис.2. Состояние белка при различных значениях рН среды
Знак заряда зависит от соотношения количеств аминных и карбоксильных групп, в соответствии с этим, условно, различают белки кислые, нейтральные и щелочные (основные). Кислотно-основные свойства белка, следовательно, заряд его молекулы зависит от рН среды.
Кислыми называются белки, которые в более или менее нейтральной среде проявляют кислые свойства. Щелочными, соответственно, белки, проявляющие при таких же условиях, щелочные свойства.
При определенном для каждого белка значении pH среды его молекулы оказываются электронейтральными. Такое состояние белковой молекулы (суммарный заряд равен нулю или близок к нулю) называется изоэлектрическим состоянием (ИЭС). Значение pH среды, при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой и обозначают pl. Изоэлектрическая точка белка зависит от числа и природы заряженных групп в молекуле. Белковая молекула заряжена положительно, если pH среды ниже pl, и отрицательно, если pH среды выше pl.
Для большинства природных белков изоэлектрическая точка находится в слабокислой зоне и в меньшем количестве - в слабощелочной. Например, изоэлектрическая точка для яичного альбумина - 4,6; казеина молока - 4,6; гемоглобина лошади - 6,6, сывороточного глобулина лошади - 4,7, гамма глобулина человека 7,3, гистонов - 8,2 и др. Однако, нужно помнить, что изоэлектрическая точка кислых белков всегда лежит в кислой среде, изоэлектрическая точка щелочных белков – в щелочной среде.
Растворы белков, как и всех высокомолекулярных соединений, обладают абсолютной агрегативной устойчивостью. Факторами устойчивости являются, во-первых, наличие одноименных зарядов на белковых частицах, которые препятствуют сближению и объединению макромолекул в более крупные агрегаты, способные выпадать в осадок; во-вторых, мощные сольватные оболочки, которыми окружена каждая макромолекула белка.
При удалении этих факторов, белки становятся наименее устойчивыми: их растворимость, набухание, вязкость становятся минимальными и, напротив, осаждаемость - максимальной.
Как известно, реакции осаждения имеют большое значение при качественных и количественных методах исследований, а также при практическом использовании белков. Эффективность осаждения, как обратимого (высаливания белка), так и необратимого, напрямую связана с кислотно-основными свойствами белка. Необратимое осаждение всегда сопровождается денатурацией белка.
Денатурация – потеря белком всех его природных свойств из-за разрушений уровней структурной организации молекулы. Нарушаются всевозможные структуры кроме первичной.
Структура белковой молекулы
Впервые, в 1888 г. А.Я.Данилевский установил, что аминокислоты в белковой молекуле соединяются путем взаимодействия –СООН и –NH2 групп, образуя связи, в последующем названные пептидными. Пептидная связь образуется при взаимодействии карбоксильной группы одной аминокислоты с аминогруппой при a -углероде – другой. При этом образуется молекула воды: например, из двух молекул аланина образуется дипептид аланил-аланин:
СН3 ¾ СН ¾ СООН + НNН ¾ СН ¾ СООН ®
ú ú
NН2 СН3
® СН3 ¾ СН ¾ СО ¾ NН ¾ СН ¾ СООН
ú ú
NН2 СН3
Соединение из двух аминокислот называют дипептидом, из трех – трипептидом и т.д. Группа атомов –СО—NН- называется пептидной группой или связью.
Основу любого полипептида (белка) составляют монотонно чередующиеся -СН – СО – NН – группы. У одного конца полипептида находится свободная –NН2 группа (N – конец, считается началом полипептидной цепи), у другого - СООН группа (С-конец). R группы аминокислот находятся на равных друг от друга расстояниях, связанные СН группами. Например:
NН2 ¾ СН ¾ СО ¾ NН ¾ СН ¾ СО ¾ NН ¾ СН ¾ СООН
ú ú ú
R1 R2 R3
Название полипептидам дается путем перечисления через дефис аминокислотных остатков, начиная с N конца, изменив их окончания на – ил. Название последней аминокислоты не меняется.
Функции и уровни структурной организации белков
Белки выполняют множество самых разнообразных функций, характерных для живых организмов. Например:
1. Структурная – белки составляют структурную основу любой живой клетки. Более 50% от общей массы сухого остатка живого организма приходится на долю белков.
2. Ферментативная (каталитическая) – все ферменты – белки. Ни одна биохимическая реакция не проходит без участия ферментов. А как известно, совокупность всех химических реакций в биообъектах составляют обмен веществ и энергии – один из основных признаков живой материи.
3. Регуляторная (гормональная) - ряд гормонов представлен белками или полипептидами, например, все гормоны гипофиза. Некоторые гормоны являются производными аминокислот.
4. Защитная функция. Основную функцию защиты в организме выполняют белки иммунной системы – иммуноглобулины или антитела. Защитная функция белков проявляется и в способствовании ряда белков плазмы крови, в частности фибриногена, к свертыванию крови.
5. Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин – специфические белки мышечной ткани.
6. Транспортная функция. Основными транспортными белками являются альбумины сыворотки крови, которые доставляют в соответствующие ткани все плохо растворимые в воде вещества. Перенос кислорода, углекислого газа осуществляется молекулами гемоглобина.
Свойства и биологические функции белков зависят также от уровней структурной организации молекулы. Различают 4 основных уровня структурной организации белковой молекулы.
- первичная структура;
- вторичная структура;
- третичная структура;
- четвертичная структура;
Под первичной структурой подразумевают аминокислотную последовательность полипептидной цепи белка. Первичная структура белка закодирована в генах, является определяющей все остальные структуры.
Полипептидные цепи индивидуальных белков за счет взаимодействия функциональных групп аминокислотных остатков приобретают определенную пространственную форму, т.е. конформацию. Молекулы всех белков с одинаковой первичной структурой образуют одинаковую конформацию.
Вторичная структура – пространственная конформация полипептидной цепи с образованием, главным образом, α-спиральной формы (рисунок-3). Различают и другие формы вторичной структуры (β-конформация или складчатый слой), надструктурные формы (суперспирализация) и др. Вторичная структура достаточно жесткая структура, т.к. витки спирали «прошиты» водородными связями между – С=О и –NH группами пептидных связей.
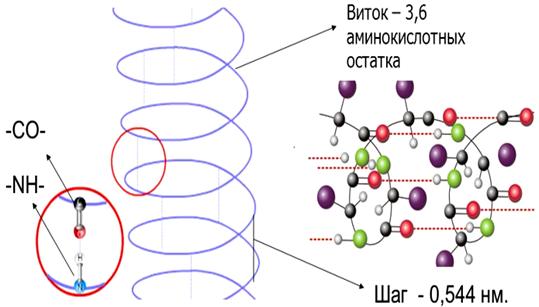
Рис. 3. Вторичная структура белка – α-спираль.
Третичная структура – пространственная конформация зависящая от способа укладки полипептидной цепи белка в пространстве с приобретением определенной глобулярной формы. В формировании третичной структуры участвуют 4 основных вида взаимодействия между различными функциональными группами R групп аминокислотных остатков.
- гидрофобное взаимодействие;
- электростатическое взаимодействие;
- водородные связи;
- ковалентные связи;
Третичная структура белка – прочная структура, но не абсолютно жесткая. В процессе выполнения биологических функций третичная структура белков может меняться. Эта особенность, например, является одним из основных факторов обеспечивающих каталитическую активность белков-ферментов.
Длинные полипептидные цепи глобулярных белков часто складываются в несколько компактных, относительно независимых областей. Они имеют самостоятельную третичную структуру, напоминающую таковую у глобулярных белков, и называются доменами. Домены обладают как с определенной структурной автономией, так и функциональной. Благодаря доменной структуре белков легче формируется их третичная структура. Отдельные домены сложных белков кодируются разными экзонами. Доменная структура большого белка сходна с четвертичной структурой, сложенной из малых белков.
Четвертичная структура характерна только для олигомерных белков, т.е. для белков состоящих из нескольких субъединиц (протомеров). Субъединицами могут быть отдельные белки или полипептиды.
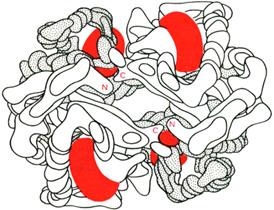 Четвертичная структура – пространственная конформация зависящая от способа совместной укладки и упаковки в пространстве отдельных полипептидных цепей или белков в третичной структуре, т.е. протомеров олигомерных белков с формированием единого в структурном и функциональном отношениях макромолекулярного образования.
Четвертичная структура – пространственная конформация зависящая от способа совместной укладки и упаковки в пространстве отдельных полипептидных цепей или белков в третичной структуре, т.е. протомеров олигомерных белков с формированием единого в структурном и функциональном отношениях макромолекулярного образования.
Рис.4. Модель гемоглобина (по Перутцу).
α-Цепи светлые; β-цепи темные; группы гема красные.
Многие функциональные белки являются олигомерными. Каждая отдельно взятая субъединица, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку.
Классификация белков
Существуют различные способы классификации белков. Вот некоторые из них:
- классификация по форме молекулы – фибриллярные и глобулярные белки;
- классификация по свойствам – кислые, нейтральные и щелочные белки;
- классификация по аминокислотному составу и биологической значимости – биологически полноценные и неполноценные белки.
Наиболее известной и широко применяемой является классификация по составу. Казалось бы, все белки состоят из аминокислот и как их дальше можно разделить? Тем не менее, согласно этой классификации белки подразделяются на две большие группы: простые белки, или протеины, и сложные белки, или протеиды.
Простые белки – протеины, состоят только из аминокислот и при гидролизе кроме них ничего не образуют.
Сложные белки – протеиды, состоят из простого белка и вещества небелковой природы (простетическая группа).
И протеины, и протеиды в свою очередь подразделяются на множество групп и классов. Основной критерий классификации простых белков – их растворимость. Различают следующие основные классы простых белков:
- альбумины – широко распространенные белки биологических объектов, хорошо растворимые в дистиллированной воде;
- глобулины – не менее известные белки в живой природе, хорошо растворимые в крепких солевых растворах;
- проламины – белки растительного происхождения, растворимые в спиртовых растворах;
- гистоны – белки с выраженными щелочными свойствами, чаще встречаются в ядре клетки в составе хроматина;
- глютелины – белки растительного происхождения (клейковина в зернах злаковых), плохо растворимые белки.
Сложные белки, прежде всего, классифицируются по характеру простетической группы:
- гликопротеиды – сложные белки, небелковая часть которых представлена углеводами;
- липопротеиды – сложные белки, небелковая часть которых представлена липидами;
- фосфопротеиды - сложные белки, небелковая часть которых представлена фосфорной кислотой;
- металлопротеиды – сложные белки, небелковая часть которых представлена ионами металлов;
- гемопротеиды – сложные белки, небелковая часть которых представлена гемом;
- нуклеопротеиды - сложные белки, небелковая часть которых представлена нуклеиновыми кислотами;
Поможем написать любую работу на аналогичную тему

