В структурно-функциональном единстве организмов белки играют ведущую роль. В природе существует примерно 1010-1012 различных белков обеспечивающих способ существования 1,2×106 видов живых организмов различной сложности организации. Каждый организм характеризуется уникальным набором белков. Так, в клетке Е.Coli содержится около 3000, а в организме человека около 5000000 различных белков.
Первые белки были выделены в 1838 г. Основной задачей стало объяснение физиологической роли белков, на основе изучения их структуры. А.Я.Данилевский впервые (1888 г.) указал на полимерный характер строения белков. Он высказал предположение, что молекула белка состоит из достаточно похожих по строению "углеазотных" цепей, с которыми соединены аминокислоты. А.Я.Данилевский утверждал, что расщепление белка идет путем гидролиза и указал на присутствие в молекуле связей типа -CO-NH-, называя их биуретовыми.
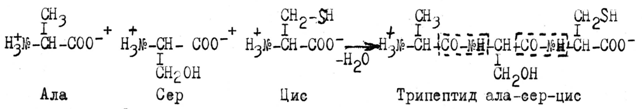 |
Немецкий химик-органик и биохимик Э.Фишер, в начале 20 в. подтвердил гипотезу А.Я .Данилевского осуществив с учениками синтез 200 пептидов. Связь -CO-NH - он назвал пептидной.
В 1902 г. Э.Фишер выдвинул полипептидную теорию строения белков, согласно которой белки представляют собой сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом пептидными связями возникающими при взаимодействии a-карбоксильных и a-аминных групп.
Аминокислоты соединяясь пептидными связями образуют молекулы пептидов. Аминокислотные звенья пептидов называют аминокислотными остатками, т.к. они потеряли молекулы воды. По числу остатков аминокислот в молекуле различают ди-, три- тетра-, пента-, гексапептиды и т.д., до 20-и аминокислотных остатков. Молекулы содержащие от 20 до 50 аминокислотных остатков называют полипептидами. Аминокислотный остаток сохранивший a±NH3 группу свободной называется N-концевым и считается началом цепочки, а остаток на противоположном конце, несущий a-COO- группу – С-коце-вым.
Многие пептиды и полипептиды животных, растений и микроорганизмов выполняют специфические функции. К ним относятся многие гормоны, яды, антибиотики и др. вещества. Примером может быть трипептид глутатион:
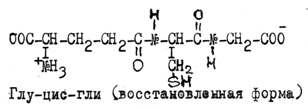 Глутатион содержится в клетках всех организмов, является сильным восстановителем, участвует в активации многих ферментов. Предполагают, что в основе долговременной памяти лежит синтез пептидов и полипептидов клетками головного мозга.
Глутатион содержится в клетках всех организмов, является сильным восстановителем, участвует в активации многих ферментов. Предполагают, что в основе долговременной памяти лежит синтез пептидов и полипептидов клетками головного мозга.
Полипептидные цепи, содержащие более 50-и аминокислотных остатков и имеющие молекулярную массу (М.м.) 6 тыс и более, относятся к белкам, Некоторые белки состоят из одной полипептидной цепи, другие содержат 2,4,6, реже 8,12 цепей, соединенных ковалентными дисульфидными связями или нековалентными (ионными, водородными, силами гидрофобного взаимодействия). Дисульфидные связи могут соединять как отдельные полипептидные цепи, так и различные участки одной полипептидней цепи. Самый низкомолекулярный (М.м.5733) белок - гормон инсулин, состоит из 2-х полипептидных цепей и 51 аминокислотного остатка. Число аминокислотных звеньев в белке может доходить до нескольких сотен и тысяч. Например, в молекуле белка-фермента - РНК-полимеразы насчитывается около 4000 аминокислотных остатков.
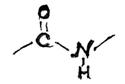 Методы рентгеноструктурного анализа (PСA) позволили Л.Полингу и Р.Кори в 40-х и начале 50-х годов определить межатомные расстояния и валентные углы в пептидной связи и установить, что все атомы пептидной связи находятся примерно в одной плоскости. Связь -С-N- короткая, частично двойная, поэтому не допускает свободного вращения.
Методы рентгеноструктурного анализа (PСA) позволили Л.Полингу и Р.Кори в 40-х и начале 50-х годов определить межатомные расстояния и валентные углы в пептидной связи и установить, что все атомы пептидной связи находятся примерно в одной плоскости. Связь -С-N- короткая, частично двойная, поэтому не допускает свободного вращения.
Основу полипептидной цепи составляют повторяющиеся фрагменты аминокислотных остатков, -R-группы которых располагаются в трансположении:
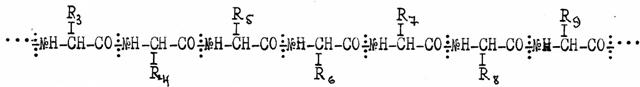
Количество белков в природе колоссально, их разнообразие связано с различным набором аминокислот и порядком их чередования в полипептидной цепи (цепях).
Поможем написать любую работу на аналогичную тему
Реферат
Белки, их строение и роль в организме. Образование пептидов, полипептидов и белков. Теория строения белка
От 250 руб
Контрольная работа
Белки, их строение и роль в организме. Образование пептидов, полипептидов и белков. Теория строения белка
От 250 руб
Курсовая работа
Белки, их строение и роль в организме. Образование пептидов, полипептидов и белков. Теория строения белка
От 700 руб

