Методами РСА расшифрованы и установлены четыре уровня структурной организации белковой молекулы.
Первичная структура - это линейная последовательность расположения аминокислотных остатков в полипептидной цепи (цепях). Первичная структура каждого белка индивидуальна и имеет колоссальную роль, т.к. в последовательности аминокислотных остатков заложена генетическая информация о последующих структурах, физико-химических свойствах и функции молекулы белка.
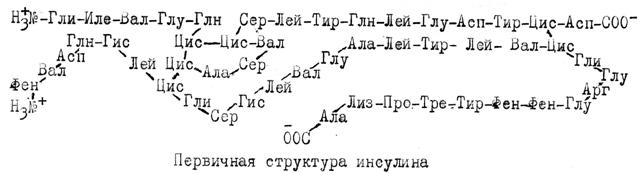 |
На сегодня установлена первичная структура более 3000 белков. Первым из них был инсулин, состоящий из 2-х полипептидных цепей (21 и 30 аминокислотных остатков). Цепи соединены двумя дисульфидными связями, в одной цепи имеется внутренняя дисульфидная (-S-S-) связь.
Если первичная структура линейная, то последующие структуры трехмерные, определяют форму укладки полипептидной цепи в пространстве.
Вторичная структура - это упорядоченное спиральное или складчатое свертывание участков полипептидной цепи по программе заложенной в первичной структуре. Так, остатки ала, лей, гис, мет, глн, три, вал, глу, фен - способствуют формированию правой a-спирали на участках полипептидной цепи где они следуют одна за другой. Остатки про, гли, тир и асн способствуют дестабилизации a-спирали. Остатки вал, иле, гли, про, сер и др. способствуют формированию b-формы или структуры складчатого слоя. Глу, про, асн, гис, сер, лиз и др. - нарушают структуры складчатого слоя.
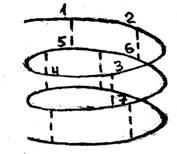 На каждый виток a-спирали приходится 3,6 аминокислотных остатка, угол подъема 260. Стабильность a-спирали обеспечивается водородными связями, возникающими между 1 и 5, 2 и б, 3 и 7 и т.д.
На каждый виток a-спирали приходится 3,6 аминокислотных остатка, угол подъема 260. Стабильность a-спирали обеспечивается водородными связями, возникающими между 1 и 5, 2 и б, 3 и 7 и т.д.
O O
II II
кислородом -C- и водородом -N- групп -C- N- связей.
I I
a- спираль H H
Поскольку число водородных связей велико, они обеспечивают компактность и
жесткость a-спирали. Степень спирализации у каждого белка индивидуальна (от 10 до 80 % аминокислотных остатков полипептидной цепи).
Складчатые участки полипептидной цепи стремятся расположиться рядом и формируют параллельные и антипараллельные b-складчатые слои
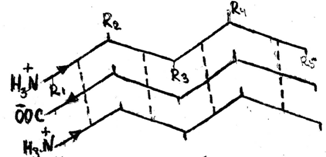 или листы, которые стабилизируются водородными связями,
или листы, которые стабилизируются водородными связями,
O
II
возникающими между -С- и -N- I
H
группами пептидных связей прилегающих друг к другу участков цепи
Антипараллельная b-структура.
Антипараллельная b-структура образуется, если складчатая цепь делает b-изгиб с поворотом назад и идет вдоль самой себя. Параллельная b-структура складывается участками полипептидной цепи, направления которых совпадают. В антипараллельной b-структуре водородные связи более прочные, чем в параллельной. R-группы аминокислотных остатков перпендикулярны плоскости b-слоев и располагаются в трансположении.
У глобулярных белков в формировании b-структуры участвует около 15 % аминокислотных остатков. Большинство складчатых слоев содержит менее шести цепей и для них характерна небольшая левая закрученность. Короткие a-спирали и b-структуры формируются в различных участках полипептидной цепи, между ними остаются неупорядоченные бесструктурные области.
Складчатые слои могут формироваться группой близко расположенных полипептидных цепей в молекуле фибриллярных белков (фиброин шелка).
Сверхвторичная структура и домены
a-Спиральные и b-структурные участки в молекулах белков взаимодействуют между собой и друг c другом образуя ансамбли: ab, babab, aa, bb и д.р. Пространственное строение таких ансамблей называют сверхвторичной структурой. babab-ансамбль сверхвторичной структуры найден в НАД+-связывающем домене дегидрогеназ. bbb-ансамбль, в виде антипараллельной 3-х цепочечной b-структуры, называется b-зигзагом, широко распространен в белках, есть он и в лактатдегидрогеназе.
Ансамбли сверхвторичной структуры являются основой для формирования в молекулах глобулярных белков доменов - структурно и функционально обособленных областей, соединенных между собой короткими бесструктурными участками полипептидной цепи (шарнирными участками). Функциональные домены формируются из одного или нескольких структурных доменов, состоящих из 100-150 аминокислотных остатков. Так, в глицеральдегидфосфатдегидрогеназе выделяют два функциональных домена: НАД+-связывающий и каталитический, формирующие активный центр фермента.
Сверхвторичные структуры в наиболее упорядоченной форме встречаются в фибриллярных белках. Установлено, что молекулы тропоколлагенов (белков соединительной ткани) состоят, из 3-х полипептидных цепей (по 1000 аминокислотных остатков) скрученных в виде 3-х жильного каната. В цепях около 35 % гли, 21 % про и опр, примерно 11 % ала. Каждая цепь имеет левую спираль, на один виток которой приходится 3 аминокислотных остатка. Наличие 21 % про и опр придает цепям жесткую изогнутую конформацию. Цепи в суперспирали соединены между собой поперечными водородными и ковалентными связями, возникающими между двумя R-группами остатков лизина соседних цепей. Тропоколлаген практически нерастяжим вследствие очень плотной скрученности. М.м. тропоколлагена около 300000. Молекулы тропоэластина (фибриллярного белка эластической соединительной ткани) по ряду свойств напоминает тропоколлаген, но по некоторым сильно от него отличается. Подобно коллагену эластин богат гли и ала, но содержит значительно больше лиз и мало про. Молекулы массой 72000, содержат около 800 аминокислотных остатков, образуют спираль особого типа в которой богатые остатками - гли спиральные участки разделены короткими участками из остатков лиз и ала. Спиральные участки растягиваются при натяжении, и возвращаются к исходной длине при снятии нагрузки. Четыре R-группы остатков лиз разных цепей сближаясь, ферментативно превращаются в десмозин, который объединяет полипептидные цепи тропоэластина поперечными ковалентными связями в системы, способные обратимо растягиваться во всех направлениях.
a-Кератины - фибриллярные белки волос, шерсти, перьев, рогов, ногтей, наружного слоя кожи и др. защитных покровов, весьма сходны по аминокислотному составу, содержат от 8 до 18 % остатков цис, богаты остатками аминокислот с гидрофобными радикалами: фен,иле,вал, мет,ала. Аминокислотный состав и последовательность аминокислотных остатков способствуют самопроизвольному образованию a-спирали. Данные РСА показали, что в протофибриллах a-кератинов от 3-х до 7-и a-спирализованных полипептидных цепей (примерно из 100 аминокислотных остатков), идущих параллельно, скручиваются вместе (образуют левую суперспираль) в 3-х - 7-и жильный "канат", в котором цепи соединены между собой поперечными водородными и дисульфидными связями. Гидрофобные R-группы остатков аминокислот расположены на поверхности. Этим объясняется прочность и нерастворимость a-кератинов.
Третичная структура характеризует уникальную пространственную укладку упорядоченных доменов, a-спиральных, b-складчатых и "бесструктурных" участков полипептидной цепи в компактную молекулу белка. Третичная структура обуславливает образование формы молекул белка с разной степенью ассиметрии (отношение длинной оси к короткой.). К нитевидным или фибриллярным белкам относят белки со степенью ассиметрии 80 и выше, это коллагены и эластины соединительной ткани, актин и миозин - сократительные белки, кератины волос, шерсти, рогов и т.д.; фиброин шелка и др. белки. При степени ассиметрии менее 80 белки относят к глобулярным; большинство из них имеет степень ассиметрии 3-5.
У глобулярных белков третичная структура формируется (как и вторичная) по программе заложенной в первичной структуре. Так, образование изгибов и поворотов цепи осуществляют остатки про, тре, сер; при этом гидрофобные R-группы стремятся внутрь, а гидрофильные - к поверхности глобулы. В поддержании и стабилизации третичной структуры участвуют силы гидрофобного взаимодействия, водородные, ионные и дисульфидные связи, т.е. третичная структура формируется и стабилизируется автоматически, образуя термодинамически наиболее устойчивую конформацию конкретного полипептида в водной среде клетки.
Ионные связи возникают между (+) и (-) заряженными R-группами остатков диаминовых и дикарбоновых аминокислот.
Гидрофобные радикалы, выталкиваемые водой, оказываются упакованными внутри глобулы, образуя гидрофобные области (ядра). Гидрофобные ядра имеют высокую плотность, характерную для многих кристаллов. Небольшое количество гидрофобных радикалов может оставаться на поверхности молекулы, образуя гидрофобные зоны.
Водородные связи образуют полярные незаряженные (частично заряженные) R-группы аминокислот (находящиеся внутри молекулы), обычно
O
֕
между собой или с группами -C- и -N - пентидных связей. Таким образом в
ï
H
целом поверхность глобулы в основном гидрофильна, но содержит и небольшие гидрофобные участки. Функциональными группами глобулярных белков
являются многие свободные радикалы расположенные на поверхности глобулы. После приобретения простым белком третичной структуры, он способен проявить свойственную ему биологическую роль и активность.
Третичная структура фибриллярных белков (коллагенов, эластинов, кератинов) животных и человека формируется, соответственно, из молекул тропоколлагена, тропоэластина и протофибрилл путем их соединения "голова к хвосту" и "бок в бок" с образованием длинных вытянутых молекул называемых фибриллами коллагенов, эластинов, кератинов.
Четвертичная структура. Белки с молекулярной массой больше 50 тыс. называются олигомерными, т.к. состоят из 2-х, 4-х, реже 6,8 и более полипептидных цепей - протомеров. Отдельная полипептидная цепь - протомер имеет свою первичную, вторичную и третичную структуру. Под четвертичной структурой понимают расположение протомеров относительно друг, друга, т.е. способ их укладки и упаковки с образованием нативной конформации молекулы белка.
Четвертичная структура многих белков формируется из протомеров двух и большего числа типов. Так, гемоглобин - тетрамер, построен- из 2-х протомеров a-типа (по 141 аминокислотному остатку) и 2-х протомеров b-типа (по 146 остатков), свернутых в глобулы с гидрофобными карманами для структур гема содержащих атом железа.
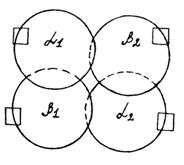
Протомеры в молекуле белка с четвертичной структурой соединяются силами гидрофобного взаимодействия, ионными и водородными связями. Специфичность ассоциации протомеров обусловлена геометрической и электростатической комплиментарностью их контактных поверхностей.
Четвертичную структуру имеют: большинство внутриклеточных глобулярных белков, фибриллярные белки соединительных и сократительных тканей, a-кератины волос, шерсти, кожи и т.д.
К настоящему времени установлена четвертичная структура нескольких сотен белков, и выяснена их функция. Глобулярные белки выполняют динамические функции: каталитическую, защитную, транспортную, регуляторную и др. Фибриллярные – главным оброзом структурную и сократительную.
Биологическая роль третичной и четвертичной структур, представляющих нативную (природно-естественную) конформацию простых и сложных белков, состоит в том, что они обеспечивают молекулам специфическую функцию и активность в системе белок + вода.
Упорядоченность пространственной структуры белков является динамичной. Значительной свободой движения обладают R-группы аминокислот, расположенные на поверхности молекулы. В процессе функционирования белковые молекулы претерпевают небольшие изменения (флуктуации), например, при соединении белковой части ферментной молекулы c кофактором, при образовании фермент-субстратного комплекса.
На конформацию белков существенное влияние оказывают условия среды (рН, ионный состав, температура и др.). Изменение параметров среды приводит к перезарядке отдельных точек, перестройке системы ионных, водородных связей и гидрофобных взаимодействий между R-группами аминокислот, т.е. к изменению конформации белка и его биологической активности. Это явление представляет собой один из основных механизмов регуляции метаболизма.
Поможем написать любую работу на аналогичную тему

