Белки в растворе являются амфотерными электролитами, т.к. их молекулы имеют и кислые и основные R-группы остатков дикарбоновых и диаминовых аминокислот. Вклад концевых аминных и карбоксильных групп в кислотно-основные свойства белков незначителен. В зависимости от соотношения – COO- и ±NH3 R-групп и реакции среды белки имеют (-) или (+) суммарный заряд и способны перемещаться в электрополе к аноду или катоду. Это свойство положено в основу разделения и очистки белков методом электрофореза.
Большинство белков всех организмов относится к кислым, их молекулы имеют (-) заряд благодаря значительному содержанию дикарбоновых аминокислот, щелочных, (+) заряженных белков в организмах, значительно меньше. Распределение заряда на поверхности молекулы неравномерно, разные участки могут иметь противоположные заряды, стабилизированные диполями воды.
Наличие большого числа заряженных групп определяет способность
белковых молекул взаимодействовать с ионами металлов, другими заряженными органическими молекулами, для выполнения функции.
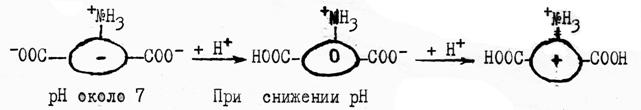
Сдвиг рН среды приводит к изменению диссоциации R-групп, перераспределению зарядов на поверхности молекулы и изменению их биологической активности. Так, молекулы кислых белков, при изменении рН раствора в кислую сторону, вначале теряют заряд, а затем преобретают (+):
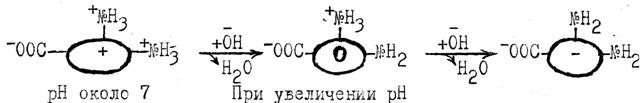
Молекулы основных белков при изменении рН раствора в щелочную сторону, вначале становятся электронейтральными, а затем преобретают (-) заряд, перезаряжаются:
Для каждого белка существует такое значение рН, при котором устанавливается равенство между (+) и (-) зарядами и суммарный заряд молекулы равен 0. Это значение рН называют изоэлектрической точкой (ИЭТ) данного белка.
ИЭТ некоторых белков:
|
Пепсин Казеин Желатин Каталаза Гемоглобин Внимание!
Если вам нужна помощь в написании работы, то рекомендуем обратиться к
профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные
корректировки и доработки. Узнайте стоимость своей работы.
|
1,0 4,7 4,9 5,6 6,8 |
Миоглобин g-глобулин человека Гистоны Химотрипсин Лизоцим |
7,0 7,3 8,2 9,5 11,0 |
ИЭТ большинства белков животных тканей лежит в пределах от 5,5
до 7,0, что свидетельствует о преобладании в них остатков кислых аминокислот.
В ИЭТ белки обладают наименьшей растворимостью, а их растворы наименьшей вязкостью и устойчивостью, легко выпадают в осадок.
Поможем написать любую работу на аналогичную тему

