1. Оксидоредуктазы. Описано более 500 ферментов катализирующих окислительно-восстановительные реакции, все двухкомпонентные, окисляют субстраты отнятием водорода или электронов, или присоединением кислорода. Большинство субстратов окисляется отнятием водорода - дегидрированием, которое осуществляют ферменты с рабочим названием дегидрогеназы. Акцепторами водорода у дегидрогеназ служат г.о. НАД+ и НАДФ+ , а также
 |
ФАД , ФМН, кислород, пероксид водорода.
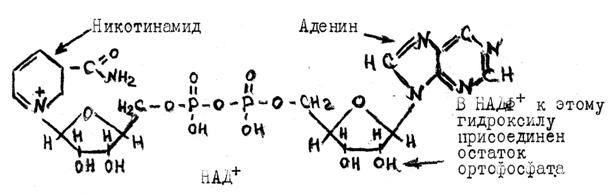
НАД+ - и НАДФ+ -зависимые дегидрогеназы, работают с коферментами НАД+ (никотинамидадениндинуклеотид) и НАДФ (никотинамидаденинди-нуклеотидфосфат) - производные витамина B5 (никотинамида).
Дегидрогеназа переносит с окисляемого субстрата 2![]() и Н+ на пиридиновое кольцо никотинамида НАД+ или НАДФ+, оставшийся Н+
переходит в среду, в результате субстрат окисляется, а кофермент - восстанавливается.
и Н+ на пиридиновое кольцо никотинамида НАД+ или НАДФ+, оставшийся Н+
переходит в среду, в результате субстрат окисляется, а кофермент - восстанавливается.
ФАД-зависимые дегидрогеназы (Флавиновые или флавопротеины). Известно около 80 флавиновых ферментов, большинство из них в качестве простетической группы содержит ФАД:
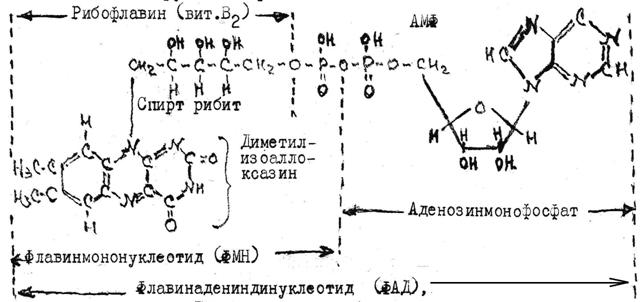
Рабочей частью флавинов является изоаллоксазиновое кольцо, способное принимать и отдавать два атома водорода.
Флавопротеины более сильные окислители, чем НАД+ и НАДФ+ -зави-симые дегидрогеназы, катализируют разнообразные окислительно-восстановительные реакции. По функции их делят на:
1. Первичные. Примером является сукцинатдегидрогеназа, окисляющая янтарную кислоту в ЦТК (Цикле трикарбоновых кислот).
2. Вторичные или промежуточные переносчики водорода с НАДН и НАДФН.
3. Оксидазы. Переносят водород с окисляемых субстратов на кислород с образованием Н2О2. Оксидазы являются металлофлавопротеинами, содержат ФАД, ФМН, железо, медь, цинк и др. металлы. Образующийся Н2О2 используется в качестве окислителя пероксидазами или расщепляется каталазой, т.к. является клеточным ядом.
Пероксидазы - дегидрогеназы (гемопротеины), переносят водороды с окисляемых субстратов на Н202:
Каталаза - дегидрогеназа (гемопротеин), разлагает избыток Н2О2 путем переноса водорода с одной молекулы Н202 на другую:
Н2О2 + Н202 ® 2Н20 + О2
Цитохромы - гемопротеины, переносят электроны на кислород с востановленных флавопротеинов и др. субстратов.
Оксигеназы - металлопротеины, катализируют реакции присоединения кислорода к субстрату.
Оксидоредуктазы подразделяются на 17 подклассов:
1.1. Ферменты окисляющие -СH-ОН группу доноров. В этот подкласс входит алкогольдегидрогеназа (КФ: 1.1.1.1), НАД+- зависимая.
1.2. Ферменты окисляющие альдегидную или кетонную группу доноров. К этому подклассу относится глицеральдегидфосфатдегидрогеназа (КФ 1.2.1.12), НАД+-зависимая (фосфорилирующая).
1.3. Ферменты окисляющие-СН-СН-группу доноров дегидрированием с образованием двойной связи. Деление подкласса на группы основано на природе акцептора: 1.3.1.-НАД(Ф)+; 1.3.2.-цитохром; 1.3.3.-кислород; 1.3.7.-железосеропротеин и 1.3.99.-прочие акцепторы.
1.4. Ферменты окисляющие -СН-NН2 группу. В этот подкласс входят ферменты, катализирующие окислительное дезаминирсвание аминокислот.
1.6. Ферменты окисляющие восстановленные НАД и ИАДФ, в основном из флавопротеинов.
1.10. ферменты окисляющие аскорбиновую кислоту: 1.10.3.3 - аскор-батоксидаза; моно-, дифенолы и близкие к ним соединения, например Аминофенолоксидаза (тирозиназа) - 1.10.3.4.
1.11. Ферменты использующие Н2О2 в качестве акцептора водорода:
каталаза КФ 1.11.1.6. и пероксидазы 1.11.1.7. 1.13.-ферменты окисляющие субстраты присоединением к ним кислорода (оксигеназы). Примером является липоксигеназа (Кф.1.13.II.12), фермент, окисляющий кислородом ненасыщенные жирные кислоты с образованием перекисей и гидроперекисей, которые имеют высокую окислительную активность и могут окислять другие ненасыщенные жирные кислоты, каротины, витамины группы А, хлорофиллы, аскорбиновую кислоту, аминокислоты и т.д. Липоксигеназа относится к железосодержащим ферментам.
2. Трансферазы, описано около тысячи ферментов, все двухкомпонентные. В зависимости от переносимых групп их делят на 8 подклассов.
2.1. Переносят одноуглеродные группы: метильные, карбоксильные и др. Примером являются метилтрансферазы, катализирующие перенос метильных групп.
2.2. Переносят альдегидные и кетогруппы. Сюда относятся трансальдолаза и транскетолаза пентозофосфатного цикла окисления глюкозы и фотосинтетического цикла Кальвина.
2.3. Ацилтрансферазы - переносят кислотные остатки и ацетилтрансферазы - переносчики ацетильных остатков от ацетил-КоА; они участвуют в синтезе липидов, ацетилглюкозамина и др.
2.4. Гликозилтрансферазы - переносят гликозильные остатки, участвуют в синтезе олиго- и полисахаридов.
2.7. Переносят группы содержащие фосфор. Сюда относятся фосфотрансферазы, переносящие фосфатный остаток от АТФ на различные субстраты-акцепторы, а также более сложные группировки, содержащие фосфатный остаток, например нуклеотидилтрансферазы и др.
2.8. Переносят серусодержащие группы, например, КоА-трансферазы.
3. Гидролазы, более 200 ферментов, однокомпонентные, многие имеют ионы металлов. Гидролазы делятся на 11 подклассов.
3.1. Гидролизуют сложноэфирные связи. Например эстеразы, фосфатазы, нуклеазы (ДНК-азы, РНК-азы).
3.2. Гидролизуют гликозильные связи. Представителями являются амилазы, полигалактуроназа, a-глюкозидаза, b-глюкозидаза, b-фруктофуранозидаза (сахараза).
3.4. Гидролизуют пептидные связи (пептид-гидролазы). В этот подкласс входит ряд ферментов, гидролизующих пептиды: аминопептидазы, - отщепляющие N-концевые аминокислоты, карбоксипептидазы - С-концевые аминокислоты, дипептидазы - гидролизующие дипептиды и несколько групп протеиназ - расщепляющих белки до пептидов. В зависимости от строения активного центра выделяют следующие группы протеиназ.
3.4.21. Сериновые протеиназы - содержат в активном центре радикал серина. Сюда относятся химотрипсин, трипсин, эластаза - протеиназы кишечного тракта, тромбин, плазмин - протеиназы крови.
3.4.22. Тиоловые пртеиназы - содержат в активном центре радикал цистеина. К ним относятся растительные протеиназы, например папаин и некоторые тканевые протеиназы (катепсин В и др.).
3.4.23. Кислые протеиназы - содержат в активном центре две карбоксильные группы остатков дикарбоновых аминокислот, их оптимум рН 1-5. К ним относятся пепсин, химозин (реннин), катепсин Д и др.
3.5. Гидрслизуют С-N-связи, отличные от пептидных. Сюда относятся аспарагиназа, глутаминаза, уреаза - расщепляющие амидные связи.
3.6. Гидролизуют кислотно-ангидридные связи - неорганическая пирофосфатаза и АТФ-азы.
3.7. Гидролизуют С-С-связи. Например, оксалоацетаза, гидролизующая оксалоацетат на оксалат и ацетат.
4. Лиазы, все двухкомпонентные, их делят на 7 подклассов.
4.1. С-С-Лиазы. К этому подклассу принадлежат фруктозодифосфа-тальдолаза, пируватдекарбоксилаза, оксалоацетатдекарбоксилаза и др.
4.2. С-0-Лиазы. Сюда относится карбоангидраза.
5. Изомеразы, двухкомпонентные. При внутримолекулярном переносе групп ферменты имеют рабочие названия мутазы, а в реакциях инверсии групп у хиральных центров - рацемазы и эпимеразы. Изомеразы делят на 6 подклассов.
5.1. Рацемазы и эпимеразы.
5.2. Цис-транс-изомеразы.
5.3. Внутримолекулярные оксидоредуктазы, катализирующие взаимопревращение альдоз и кетоз, перемещают С=С-связи. Например, в реакции глицеральдегид-3-фосфат (ГАФ) « Дигидроксиацетонфосфат (ДГАФ), катализируемой глицеральдегид-3-фосфат кетол-изомеразой (рабочее название триозофосфат-изомераза), у 1-С атома ГАФ идет восстановление, у второго - окисление.
6. Лигазы (синтетазы), все двухкомпонентные, делятся на 5 подклассов в зависимости от образуемой связи.
6.1. Образуют С-0-связи. Примером может быть аминоацил-тРНК-синтетазы (образующие AМФ), которые активируют аминокислоты и передают их
на тРНК.
6.2. Образуют С-S-связи, присоединяя остатки различных кислот к КоА
макроэргической связью.
6.3. Образуют С-N-связи, например, в синтезе аминов аспарагиновой и глутаминовой кислот.
6.4. Образуют С-С-связи. К этому подклассу относятся альдолаза, карбоксилазы и др.
Поможем написать любую работу на аналогичную тему

