В ядре, ферменты транскрипции постоянно катализируют синтез различных РНК. На определенных этапах жизненного цикла организма (клетки) транскрибируются (переписываются) только определенные гены для синтеза белков, обеспечивающих плавное течение процессов метаболизма и физиологических функций.
В результате транскрипции синтезируются три типа РНК. Во-первых, это мРНК,которая определяет синтез одного (или нескольких) полипептидов, аминокислотная последовательность которых была закодирована геном (или группой генов) в хромосоме.
мРНК синтезируется мРНК-полимеразой, которой необходимы рибонуклеозидтрифосфаты (АТФ,ГТФ,УТФ и ЦТФ) в качестве нуклеотидных остатков обогащенных энергией.РНК-полимераза удлиняет цепь РНК, присоединяя рибонуклеотидные остатки фосфодиэфирной связью к 3’-ОН концу, в направлении 5'®3' с образованием пирофосфата. Из двух цепей ДНК транскрибируется одна по принципу комплементарности: против Адениловых остатков ДНК-матрицы, в синтезируемую цепь РНК включаются остатки Уридиловой кислоты, против Тимидиловых - остатки Адениловой, остатки Гуаниловой и Цитидиловой в ДНК - определяют включение соответственно остатков Цитидиловой и Гуаниловой кислот. Благодаря комплементарности синтеза информация гена о первичной структуре белка (полипептида), переписывается на мРНК.
Из синтезированных предшественников мРНК затем образуются зрелые мРНК, которые модифицируются путем присоединения поли (А)-хвоста к 3'-концу и покидают ядро.
Ядра клеток содержат три группы РНК-полимераз, синтезирующих м,р и тРНК. Скорость транскрипции в клетках Е.Соli около 50 нуклеотидов в 1сек.
В цитоплазме мРНК появляются в форме рибонуклеопротеиновых комплексов (мРНП-комплекс или мРНП-частица). В состав мРНП-частицы входят одна молекула мРНК и белки в соотношении (по массе) 1:3-1:4. Белки маскируют мРНК и обеспечивают её хранение. Включение мРНП-комплекса в синтез белка (в полисому) сопровождается изменением в составе белков: отщеплением или модификацией репрессорных и присоединением активаторных белков (факторов инициации, элонгации и др.). Таким оброзом, в эукариотических клетках мРНК всегда находится в комплексе с белками, от момента синтеза в ядре до распада в цитоплазме.
Процесс биосинтеза белка (трансляция гена) универсальный у всех организмов, т.к. основан на двух фундаментальных принципах живой природы - матричности и комплементарности, осуществляется на рибосомах с участием мРНК и тРНК.
Трансляция -это перевод информации мРНК в последовательность аминокислотных остатков полипептидных цепей. В ходе трансляции синтезируются все белки клетки. Сначала происходит активирование аминокислот,затем протекает сборка полипептидной цепи на рибосомах .При этом триплеты мРНК определяют последовательность аминокислотных остатков. Трансляция протекает в три этапа: инициация (начало синтеза), элонгация (удлинение) полепетида, терминация (конец информации)синтеза и высвобождение полипептидной цепи.
Центром биосинтеза является рибосома. Если рибасома не связана с мРНК, она диссоциирует на субединицы 40S и 60S. (См.раздел 3.3.3.). В биосинтезе полипиптида, помимо белков рибосомы, участвуют три группы белков цитоплазмы, их называют факторами инициации, элонгации и терминации.
Активирование аминокислот осуществляется в цитоплазме ферментами, обладающими специфичностью к определенной аминокислоте и к соответствующей ей тРНК, за счет энергии АТФ. В клетках эукариот ферменты активирования - аминоацил-тРНК-синтетазы объединены в мультиферментный комплекс.
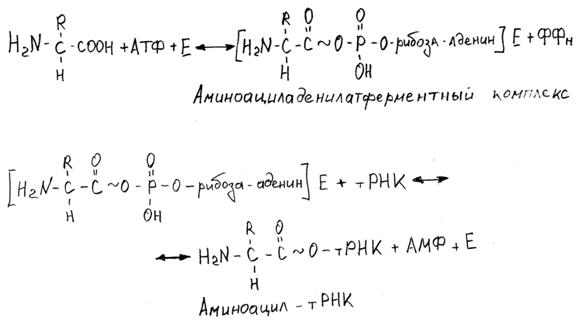 |
Реакция активирования протекает в две стадии, завершается этерификацией аминокислоты соответствующей молекулой тРНК (a-COO--группа аминокислоты образует макроэнергетическую сложно-эфирную связь с 3’-ОН-группой концевого аденилового остатка акцепторного конца тPHK):
Инициация (начало синтеза). Это наиболее сложный этап трансляции, т.к. на этой стадии происходит сборка рибосомы и присоединение к ней 5¢- концом мРНК. К инициирующему кодону АУГ мРНК прикрепляется водородными связями антикодон УАЦ инициаторной метионил- тРНК за счёт энергии ГТФ. Этот процесс осуществляется факторами инициации (elF-5, elF-2, elF-3). На заключительном этапе факторы инициации высвобождаются, рибосома “собрана”, “снабжена” информацией мРНК и готова для синтеза полипептидной цепи.
В процессе инициации в рибосоме образуются два участка связывания: аминоацил-тРНК (А-участок) и пептидил-тРНК (П-участок). Инициирующая Мет-тРНК может связываться только с П-участком, все остальные вновь поступающие аминоацил-тРНК присоединяются к А-участку. П-участок - это место рибосомы, с которого уходят освободившиеся от аминокислот тРНК и к которому прикрепляется растущая пептидил-тРНК.
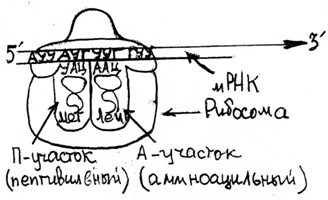
Элонгация (удлинение) полипептидной цепи - это повторяющийся процесс присоединения аминокислотных остатков к растущей полипептидной цепи. Процесс протекает в три стадии при участии факторов элонгации (ЕF-1, EF-2).
По окончании процесса инициации в П-участке находится мет-тРНК, А-участок свободен и в нем находится следующий кодон мРНК (УУГ). См. генетический код на 101 стр.
На первой стадии цикла в А-участок рибосомы поступает комплементарная находящемуся в нем кодону лейцил-тРНК, связывается водородными связями при сближении кодон-антикодоновых пар фактором элонгации FF-1 за счет энергии ГТФ.
На второй стадии цикла образуется пептидная связь между аминокислотами, тРНК которых расположены в А- и П-участках рибосомы. -Фермент пептидилтрансфераза, входящий в состав 6ОS-субчаcтицы, переносит метиониновый остаток (пептидильный остаток в последующих циклах элонгации) на аминогруппу аминокислотного остатка, расположенного в А-участке. Эта реакция протекает по механизму нуклеорильного замещения (вытеснением тРНК предыдущей аминокислоты). В результате, в А-участке образуется дипептидил- тРНК а в П-участке остается "пустая" инициирующая тРНК (Метнониновая).
На третьей стадии рибосома перемещается по мРНК к её З' концу на один кодон, при этом дипептидил-тРНК, связанный со вторым кодоном мРНК, перемещается из А-участка в П-участок, инициирующая тРНК (Метнониновая) отделяется от П-участка и выходит в цитоплазму. Теперь в А- участке находится третий кодон мРНК, а второй кодон оказывается в П-участке. Передвижение рибосомы вдоль мРНК называется транслокацией, осуществляется при участии фактора элонгации EF-2 за счет энергии ГТФ.
Теперь рибосома готова к присоединению третьего аминокислотного остатка. На присоединение каждой аминокислоты затрачиваются две молекулы ГТФ, которые гидролизуются до ГДФ и Фн. По мере движения рибосомы от кодона к кодону по мРНК аминокислотные остатки один за другим присоединяются к растущей полипептидной цепи в соответствии с информацией содержащейся в мРНК.
Терминация (конец информации) синтеза. О терминации синтеза полипептида сигнализирует один из трех терминирующих кодонов: УАА, УАГ, УГА мРНК, расположенный за кодоном последней аминокислоты. В терминации у эукариот участвует белковый фактор терминации eRF, он присоединяется к терминирующему кодону и блокирует дальнейшую элонгацию цепи. Считают, что терминирующий кодон и белковый фактор обуславливает: l) гидролитическое отщепление последней тРНК и высвобождение полипептида; 2) отделение от П-участка последней "пустой" тРНК; 3) диссоциацию рибосомы на 40S и 60S-субчастицы.
Все освобождающиеся "участники" белоксинтезирующей системы (белковые факторы инициации, элонгации, терминации; субчастицы рибосомы, тРНК) используются вновь, в очередном цикле синтеза полипептида.
Для обеспечения точности биологического перевода генетической информации мРНК на аминокислотную последовательность синтезируемого белка затрачивается чуть более четырех высокоэнергетических фосфатных групп на присоединение каждого аминокислотного остатка: две высокоэнергетические фосфатные группы АТФ на синтез аминоацил-тРНК, одна фосфатная группа ГТФ расходуется на связывание и узнавание тРНК А-участком, одна фосфатная группа ГТФ используется на транслокацию рибосомы; по одной высокоэнергетической фосфатной группе ГТФ требуется на инициацию и терминацию синтеза полипептида.
Полисомы. Скорость синтеза полипептидной цепи у бактерий составляет 300-400, у животных и растений 30-50 аминокислотных остатков в I мин. Установлено, что одну мРНК, как правило, транслируют одновременно несколько (от 3-х до 80 и более) рибосом. Такие "агрегаты", названные полисомами, были изучены с помощью электронного микроскопа. Полисомы значительно увеличивают скорость синтеза полипептида и эффективность использования мРНК.
Образование нативной конформации. Синтезированный полипептид становится биологически активным после образования присущей ему нативной конформации, которая определяется аминокислотной носледовательностью. В какой-то момент - во время синтеза полипептидной цепи или после его завершения - белок самопроизвольно принимает нативную конформацию. Однако часто синтезированная полипептидная цепь должна предварительно подвергнуться процессингу или модификации. У разных белков процессинг протекает по-разному: 1). Модификация N-конца осуществлявтся ферментами, которые отщепляют инициирующий Мет, а часто и несколько следующих за ним аминокислотных остатков.
2). Фосфорилирование гидроксильных групп некоторых cериновых, треониновых и тирозиновых остатков за счет АТФ, увеличивает отрицательный заряд молекул белков. В казеине молока содержится много фосфосериновых остатков, роль которых состоит в связывании ионов Co2+ Фосфорилирование гидроксильных групп определенных остатков серина необходимо для активации некоторых ферментов, например гликоген-фосфорилазы.
3). Углеводные цепи у гликопротеинов присоединяются ковалентно к полипептиду во время или после синтеза. Ферменты прикрепляют углеводные цепи одним гликопротеинам к остаткам аспарагиновой кислоты, другим - к остаткам серина или треонина.
4). В состав многих ферментов входят ковалентно связанные с белком простетические группы, они присоединяются к полипептидной цепи после её отделения от рибосомы. Примерами могут служить молекула биотина в ацетил-КоА-карбоксилазе и гемовая группа в цитохроме с.
5). Во многих белках, предназначенных для вывода из эукариотической клетки (на "экспорт"), в процессе формирования нативной конформации ферменты образуют дисульфидные мостики (между остатками цистеина), которые повышают устойчивость молекулы белка к денатурации, и т.д.
Поможем написать любую работу на аналогичную тему

