Для протекания любой реакции необходимо чтобы молекула (-лы) обладала достаточным запасом энергии для преодоления энергетического барьера реакции обусловленного силами межатомного сцепления (в реакциях распада) и сил межмолекулярного отталкивания (в реакциях синтеза). Т.е. химическая реакция может произойти, если молекулы будут активированы, получат определенное дополнительное количество энергии, называемое энергией активации (Еа). Каждый тип молекул, имеет свою величину Еа. При работе фермента, снижается энергетический барьер реакции благодаря образованию фермент- субстратного комплекса (ES), в котором фермент (Е) действует на субстрат (S), делая его реакционно-способным (S'). ферментативная реакция протекает не в один этап а через несколько промежуточных стадий, энергетический барьер при этом разбивается на несколько более низких барьеров, преодолеть которые реагирующим молекулам легче, чем один большой барьер. При этом все промежуточные реакции вместе требуют гораздо меньшей анергии активации, чем реакция идущая без катализатора. В реакции, катализируемой ферментом можно выделить следующие промежуточные стадии:
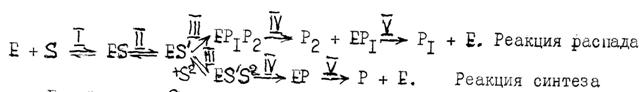
где Е - фермент, S- субстрат, S2- второй субстрат, S¢-реакционно-способный субстрат, Р - продукт,EP -фермент- продуктный комплекс.
Теорию промежуточных соединений впервые предложил М.В.Ненцкий (1898). Положение об образовании ЕS было развито Л.Михаэлисом и его сотрудницей М.Ментен (I9I3). В последствии удалось выделить в кристаллическом виде некоторые ES- и подтвердить теорию ферментативного катализа экспериментально.
Поможем написать любую работу на аналогичную тему

