Живой организм и его функционирование находятся в постоянной зависимости от окружающей среды. Все превращения органических веществ, процессы анаболизма и катаболизма тесно связаны друг с другом. В организме человека и животных, как и в живой природе вообще, не существует самостоятельного обмена белков, жиров, углеводов и нуклеиновых кислот. Все превращения объединены в целостный процесс метаболизма, все взаимопревращения диктуются физиологическими потребностями организма, а также целесообразностью замены одних органических веществ другими.
Еще Кребс и Корнберг отмечали, что, несмотря на огромное разнообразие пищевых веществ, число химических реакций, обеспечивающих их превращения и образование энергии, «удивительно мало». Эти закономерности свойственны как организму животных и человека, так и микроорганизмам и растениям.
В настоящее время экспериментально обосновано существование трех главных этапов распада молекул углеводов, белков и жиров, которые интегрируют образование энергии из основных пищевых источников. На I этапе полисахариды расщепляются до моносахаридов (обычно гексоз); жиры распадаются на глицерин и высшие жирные кислоты, а белки – на составляющие их свободные аминокислоты. Следует подчеркнуть, что указанные процессы в основном являются гидролитическими, поэтому освобождающаяся в небольшом количестве энергия почти целиком используется организмами в качестве тепла.
На II этапе мономерные молекулы (гексозы, глицерин, жирные кислоты и аминокислоты) подвергаются дальнейшему распаду, в процессе которого образуются богатые энергией фосфатные соединения и ацетил-КоА. Только для аминокислот ситуация на II этапе несколько отлична. При преимущественном использовании аминокислот в качестве источника энергии (при дефиците углеводов или при сахарном диабете) некоторые из них непосредственно превращаются в метаболиты лимоннокислого цикла, другие – опосредованно через глутамат (пролин, гистидин, аргинин), третьи – в пируват и далее в ацетил-КоА. В целом, II этап можно назвать этапом образования ацетил-КоА, являющегося по существу единым (общим) промежуточным продуктом катаболизма основных пищевых веществ в клетках.
На III этапе ацетил-КоА (и некоторые другие метаболиты, например α-кетоглутарат, оксалоацетат) подвергаются окислению («сгоранию») в цикле ди- и трикарбоновых кислот Кребса. Окисление сопровождается образованием восстановленных форм НАДН2 и ФАДН2.
В заключении осуществляется перенос электронов от восстановленных нуклеотидов на кислород (через дыхательную цепь). Он сопровождается образованием конечного продукта – молекулы воды. Этот транспорт электронов сопряжен с синтезом АТФ в процессе окислительного фосфорилирования.
Необходимо отметить, что, помимо взаимных переходов между разными классами веществ в организме, доказано существование более сложных форм связи. В частности, интенсивность и направление любой химической реакции определяются ферментами, т.е. белками, которые оказывают непосредственное влияние на обмен липидов, углеводов и нуклеиновых кислот.
Помимо прямых переходов метаболитов этих классов веществ друг в друга, существует тесная энергетическая связь, когда энергетические потребности могут обеспечиваться окислением какого-либо одного класса органических веществ при недостаточном поступлении с пищей других. Важность белков (в частности, ферментов, гормонов и др.) в обмене всех типов химических соединений слишком очевидна и не требует доказательств. Неоспорима большая роль белков и аминокислот для синтеза ряда специализированных соединений (пуриновые и пиримидиновые нуклеотиды, порфирины, биогенные амины и др.). Кетогенные аминокислоты, образующие в процессе обмена ацетоуксусную кислоту (ацетоацетил-КоА), могут непосредственно участвовать в синтезе жирных кислот и стеринов. Аналогично могут использоваться гликогенные аминокислоты через ацетил-КоА, но после предварительного превращения в пируват.
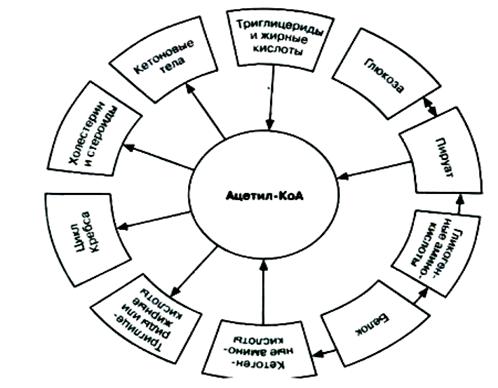 Рис.25. Участие ацетил – КоА в метаболизме.
Рис.25. Участие ацетил – КоА в метаболизме.
Некоторые структурные компоненты специализированных липидов, в частности фосфоглицеринов, имеют своим источником аминокислоты и их производные, например серин, этаноламин, сфингозин и холин. Необходимо подчеркнуть, что превращение углеродных скелетов кетогенных или гликогенных аминокислот в жирные кислоты является необратимым процессом. В то же время из глицерина нейтральных жиров через пируват полностью осуществляется синтез углеродных скелетов некоторых гликогенных аминокислот.
Продукты гидролиза пищевых и тканевых триацилглицеролов, в частности высшие жирные кислоты, участвуют непосредственно в образовании сложных белков – липопротеинов плазмы крови. В составе липопротеинов, являющихся, таким образом, транспортной формой жирных кислот, они доставляются в органы-мишени, в которых жирные кислоты служат или источником энергии (сердечная и поперечно-полосатая мускулатура), или предшественниками синтеза тканевых триацилглицеролов с последующим их отложением в клетках ряда органов (депо липидов).
Получены доказательства синтеза глюкозы из большинства аминокислот. Для некоторых аминокислот (аланин, аспарагиновая и глутаминовая кислоты) связь с глюконеогенезом является непосредственной, для других она осуществляется через побочные метаболические пути. Следует особо подчеркнуть, что три α-кетокислоты (пируват, оксалоацетат и кето-глутарат), образующиеся соответственно из аланина, аспартата и глутамата, не только служат исходным материалом для синтеза глюкозы, но являются своеобразными кофакторами при распаде ацетильных остатков всех классов пищевых веществ в цикле Кребса для получения энергии.
Доказано также, что исходными субстратами для глюконеогенеза являются те аминокислоты, распад которых сопровождается образованием пировиноградной кислоты (например, аланин, серин, треонин и цистеин). Более того, имеются доказательства существования в организме своеобразного циклического процесса – глюкозоаланинового цикла, участвующего в тонкой регуляции концентрации глюкозы в крови в тех условиях, когда в период между приемами пищи организм испытывает дефицит глюкозы.
Энергетическая ценность пищи оказывает определенное влияние на белковый обмен, контролируемый азотистым балансом. Так, если потребляемая энергия пищи ниже минимального уровня, то наблюдается увеличение экскреции азота, и, наоборот, при увеличении энергетической ценности пищи экскреция азота с мочой снижается. Между циклом лимонной кислоты и орнитиновым циклом мочевинообразования имеются сложные связи, определяющие в известной степени скорость реакций, зависимую от энергетических потребностей клетки и концентраций конечных продуктов метаболизма. Этот механизм получил название «велосипед Кребса» (The "Krebs bicycle").
Имеются различные пути взаимопревращений жиров и углеводов. Практика откорма сельскохозяйственных животных давно подтвердила возможность синтеза жиров из углеводов пищи. С энергетической точки зрения, превращение углеводов в жиры следует рассматривать как накопление и депонирование энергии, хотя синтез жира сопровождается затратой энергии, которая вновь освобождается при окислении жиров в организме. Глицерин, входящий в состав триацилглицеролов и фосфоглицеринов, может легко образоваться из промежуточных метаболитов гликолиза, в частности из глицеральдегид-3-фосфата. Следует, однако, подчеркнуть, что основным путем превращения углеводов в жиры является путь образования высших жирных кислот из ацетил-КоА, который образуется при окислительном декар-боксилировании пирувата. Последняя реакция практически необратима, поэтому образования углеводов из высших жирных кислот почти не происходит.
Таким образом, синтез углеводов из жиров в принципе может происходить только из глицерина, хотя в обычных условиях реакция протекает в обратную сторону, т.е. в сторону синтеза жиров из глицерина, образующегося при окислении углеводов. Ацетил-КоА, образующийся в процессе обмена углеводов, жиров и ряда аминокислот, служит пусковым субстратом как для синтеза жирных кислот (а следовательно, и липидов вообще), так и для цикла трикарбоновых кислот.
Для окисления ацетил-КоА в этом цикле требуется оксалоацетат, который является вторым ключевым субстратом в цикле Кребса. Оксалоацетат может синтезироваться из пировиноградной кислоты благодаря реакции карбоксилирования или образоваться из аспарагиновой кислоты в процессе трансаминирования с α-кктоглутаратом.
Две молекулы ацетил-КоА, конденсируясь, образуют ацетоуксусную кислоту (ацетоацетат), которая является источником других кетоновых тел в организме. Эти же реакции конденсации двух молекул ацетил-КоА составляют начальные этапы синтеза холестерина, в свою очередь являющегося предшественником гормонов стероидной природы, витамина D3, а также желчных кислот.
Следует указать также на использование галактозы и частично глюкозы для биосинтеза цереброзидов и гликолипидов, выполняющих важные и специфические функции в деятельности ЦНС. В этом синтезе участвуют не свободные моносахариды, а гексозамины (галактозамин и глюкозамин), биосинтез которых в свою очередь требует доставки амидного азота глутамина, интегрируя тем самым обмен углеводов, липидов и белков.
В последние годы накоплено немало экспериментальных данных, свидетельствующих о существовании в живых организмах множества регулирующих механизмов, осуществляющих метаболический контроль и обеспечивающих как взаимопревращения белков, липидов и углеводов, так и интеграцию энергии. Доказано, что движущей силой во взаимопревращениях веществ и интенсивности метаболизма, вероятнее всего, является энергетическое состояние клетки, в частности уровень АТФ (точнее, отношение АМФ/АТФ). Так, при низких концентрациях АМФ и высоких концентрациях АТФ (состояние, которое принято обозначать «энергонасыщенностью») в клетках происходит резкое снижение гликолитического распада глюкозы, и наоборот усиление синтеза полисахарида – гликогена.
При низких концентрациях АТФ (соответственно при высоком уровне АМФ) в клетках отмечаются стимулирование гликолиза и окисление пирувата в лимоннокислом цикле, что способствует обеспечению клеток энергией. Однако при низких концентрациях АМФ имеет место снижение скорости цикла трикарбоновых кислот, обусловленное торможением активности изоцитратдегидрогеназы, соответственно наблюдается снижение скорости синтеза АТФ и накопление изолимонной кислоты. Последняя, как известно, повышает активность другого фермента – ацетил-КоА-карбоксилазы, которая в свою очередь катализирует I стадию превращения ацетил-КоА в жирную кислоту. Благодаря этим обстоятельствам клетка переводит образовавшуюся при гликолизе молекулу ацетил-КоА с энергетического пути на путь синтеза липидов и их отложения в депо. В то же время при восстановлении скорости утилизации АТФ, что обычно наблюдается при синтезе жирных кислот, соответствующее повышение уровня АМФ способствует снижению концентрации лимонной кислоты и соответственно торможению синтеза липидов.
Перечисленные примеры лишь в малой степени характеризуют многообразие и тесную взаимосвязь между процессами обмена веществ.
Общий ход биохимических процессов в организме представляет собою единое целое, а организм – самонастраивающуюся, саморегулируемую систему, поддерживающую свое существование путем обмена веществ.
Процессы обмена белков, углеводов, жиров и других соединений в живом организме неразрывно связаны друг с другом. Без этой взаимосвязи невозможно существование самого организма.
В связи с этой особенностью, рассказывая о жирорастворимых витаминах, точнее будет, если говорить группа витаминов …..
Поможем написать любую работу на аналогичную тему

