При определенных условиях две различные фазы одного вещества (например, жидкость и газ) могут сосуществовать друг с другом сколь угодно долгое время. Для этого необходимо выполнение следующих условий на границе двух фаз:
![]() ,
, ![]() и
и ![]() .
.
Вывести условия равновесия из каких-то принципов, распределений!
Первое условие необходимо для теплового равновесия, второе для механического равновесия, а третье для равновесия по числам частиц. При невыполнении хотя бы одного из этих условий между фазами будет существовать либо поток тепла, либо на границу раздела фаз будет действовать сила, либо частицы будут переходить из одной фазы в другую.
Химический потенциал связан с энергией Гиббса соотношением
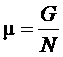 .
.
Для газа Ван-дер-Ваальса можно провести линию, которая будет соответствовать равновесию фаз. Эта линия называется бинодаль. Положение бинодали определяется равенством площадей, отсекаемых горизонтальной линией от зависимости p(V).
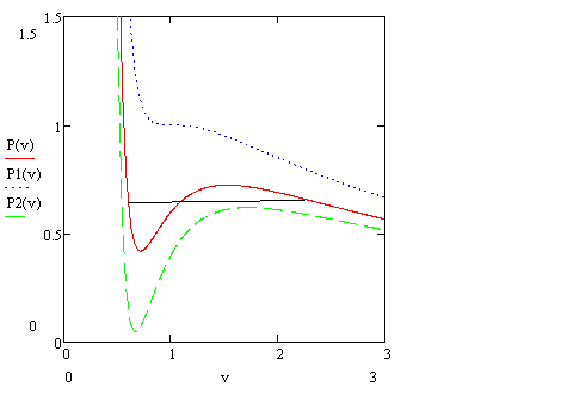
Рис. 3.2
Линия, соответствующая точкам экстремума для различных изотерм, называется спинодаль.
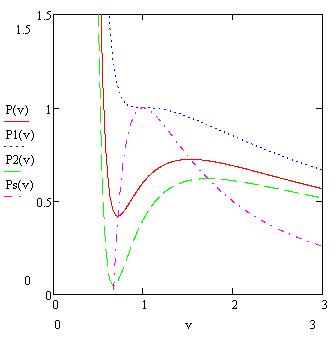
Рис. 3.3
Можно показать, что спинодаль находится всегда внутри бинодали. Так же как и спинодаль, бинодаль всегда имеет максимум в критической точке. Внутри спинодали однофазное состояние находиться не может ввиду его неустойчивости – там всегда находится двухфазное состояние. Между спинодалью находится область метастабильных состояний. То есть состояний, существующих конечное время, но из-за случайных флуктуаций переходящих со временем в двухфазное состояние. За бинодалью находится область однофазных состояний, когда существование двухфазного состояния невозможно.
Если изотермически сжимать газ Ван-дер-Ваальса, начиная с больших объемов, то будет происходить следующее. Сначала в объеме будет газ (пар), потом будет возникать капля жидкости, потом жидкости будет все больше, пока она не займет весь объем. Потом будет только жидкость, которая практически несжимаема. Переход от жидкого состояния в твердое, или из газообразного в жидкое называется фазовым переходом первого рода. При этом удельная энтропия вещества и его удельный объем испытывают скачок. При фазовых переходах второго рода эти величины испытывают излом.
Однако возможен и другой сценарий, связанный с существованием метастабильных фаз. В этом случае, если в системе нет возмущений, и вещество практически не имеет примесей, при изотермическом сжатии газа переход его в жидкое состояние начнется не на бинодали, а при меньшем объеме. Такое состояние пара называется «пересыщенным». В свою очередь, при расширении жидкости после бинодали будет существовать «перегретая жидкость». Оба эти состояния являются метастабильными в том смысле, что они устойчивы по отношению с малым возмущениям, но неустойчивы по отношению к конечным возмущениям. Но поскольку возмущения носят чаще всего случайный характер, конечное возмущение рано или поздно наступает. В этом случае метастабильное состояние распадается с образованием стабильной фазы. Например, при нагревании воды ее кипение может начаться не при 1000С, а при несколько большей температуре.
Основными видами метастабильных состояний являются перегрев и переохлаждение.
Переохлаждение – охлаждение вещества ниже температуры равновесного перехода в другое агрегатное состояние (фазу); частный случай перевода системы в метастабильное состояние. В последовательности фазовых переходов от высокотемпературных к низкотемпературным фазам (пар ® жидкость ® кристалл I® кристалл II) возможно переохлаждение каждой фазы по отношению к последующей. Переохлаждение необходимо, чтобы фазовый переход 1-го рода происходил с конечной скоростью. Большое переохлаждение однородной системы может быть обусловлено отсутствием зародышей конкурирующей фазы или очень медленным их ростом вследствие малой подвижности молекул.
Для металлических капель наблюдались следующие переохлаждения ![]() где
где ![]() – равновесная температура кристаллизации: 52 К (Hg), 122 K (Sn), 296K (Ge), 277K (Cu). В атмосфере вода так же может находиться в переохлажденном состоянии. Например, маленькие капли воды могут находиться в атмосфере в жидком состоянии до -40оС.
– равновесная температура кристаллизации: 52 К (Hg), 122 K (Sn), 296K (Ge), 277K (Cu). В атмосфере вода так же может находиться в переохлажденном состоянии. Например, маленькие капли воды могут находиться в атмосфере в жидком состоянии до -40оС.
Перегрев – нагрев конденсированной фазы до температуры, превышающей температуру равновесия с другой фазой, так что исходная фаза оказывается в метастабильном состоянии. Предельный перегрев соответствует спинодали. Жидкости удаётся перегреть значительно выше температуры равновесия с паром ![]() . Перегрева можно достичь не только повышением
. Перегрева можно достичь не только повышением ![]() , но и уменьшением внешнего давления
, но и уменьшением внешнего давления ![]() ниже
ниже ![]() .
.

Рис. 3.5
На рисунке 3.5 кружками отмечены экспериментальные значения ![]() для гомогенного вскипания аргона при изобарическом нагреве в стеклянной трубке: нижняя кривая – линия насыщения (бинодаль), верхняя кривая – спинодаль.
для гомогенного вскипания аргона при изобарическом нагреве в стеклянной трубке: нижняя кривая – линия насыщения (бинодаль), верхняя кривая – спинодаль.
Поможем написать любую работу на аналогичную тему

