1. Особенности обмена белка.
2. Катаболизм аминокислот.
3. Универсальные процессы в катаболизме аминокислот.
4. Способы обезвреживания аммиака.
5. Биосинтез белка.
Обмен белка занимает центральное место среди многообразных процессов метаболизма, свойственных живой материи. Все другие виды обмена — углеводный, липидный, нуклеиновый, минеральный и др. прежде всего обслуживают обмен белков и в т.ч. специфический биосинтез белка. Белковый обмен весьма строго специфичен, обеспечивает непрерывность воспроизводства и обновления белковых тел организма.
Именно белковый обмен координирует, регулирует и интегрирует многообразие химических превращений в целостном живом организме, подчиняя его сохранению вида, непрерывности жизни. По сравнению с другими видами обмена веществ обмен белка имеет ряд особенностей.
Особенности обмена белка
Одной из характерных особенностей белкового обмена является его чрезвычайная разветвлённость. В превращениях 20 с лишним аминокислот белковой молекулы в организме животных участвуют несколько сотен промежуточных продуктов, тесно связанных с метаболитами обмена углеводов и липидов. Блокирование какого - либо специфического пути обмена, даже одной аминокислоты может привести к появлению совершенно неизвестных продуктов.
Состояние белкового обмена определяется множеством факторов, как экзогенных, так и эндогенных. Большое значение при этом играет биологическая полноценность белков пищи (корма). Любые отклонения от нормального физиологического состояния организма, нарушения в обмене углеводов, липидов и др. незамедлительно отражаются на азотистом обмене.
Состояние обмена белка в живом организме можно характеризовать балансом азота. Этот термин означает количественную разницу между введенным с пищей азота и выведенным его в виде конечных продуктов выраженных в одинаковых единицах. Поскольку, как основная масса азота пищи представлена белками, так и большинство выделяемых конечных азотистых продуктов является следствием распада белка, принято считать, что для правильной оценки состояния обмена белков достаточно точным критерием может быть определение азотистого баланса. Кроме того, среднее содержание азота в белках, более или менее постоянная величина и составляет 16%. Для пересчета общего азота на белок нужно найденное его общее количество умножить на коэффициент 6,25. С понятием азотистого баланса тесно связана проблема о нормах белка в кормлении животных.
Различают 3 вида азотистого баланса организма: положительный, нулевой (азотистое равновесие) и отрицательный.
В клинической биохимии различают понятия белковый и небелковый азот. Количество небелкового азота в крови животных не велико и находится в пределах 20—60 мг%. Сюда входят, в основном, азот мочевины, аминокислот, мочевой кислоты креатина и креатинина, индикана и др. Небелковый азот крови называют также остаточным азотом, то есть остающийся в фильтрате после осаждения белков.
У здоровых животных колебания в содержании небелкового азота в крови незначительны и в основном зависят от количества поступающих с кормом белков. Однако, многие патологические состояния сопровождаются резким повышением содержания небелкового азота в крови. Такое состояние носит название азотемии.
Основные особенности обмена белков проявляются на стадии промежуточного обмена и их можно объяснить двумя факторами:
Во-первых, энергетическая ценность аминокислот не высока и выполняют в клетке, прежде всего, функции строительных материалов. В связи с этим, в обмене белков центральную роль играют не процессы катаболизма, а анаболизма, т.е. синтеза белка. Во-вторых, в живой клетке не существуют единые, универсальные механизмы расщепления аминокислот. Каждая аминокислота подвергается распаду по индивидуальному механизму.
Катаболизм аминокислот
Если известно 20 белковых аминокислот, то в каждой клетке, как минимум, функционируют 20 путей их катаболизма. Однако, несмотря на такое многообразие катаболических путей, конечных продуктов тканевого обмена аминокислот немного, т.е. 20 способов расщепления аминокислот на определенных этапах сливаются и приводят к образованию всего лишь 5 различных продуктов, которые 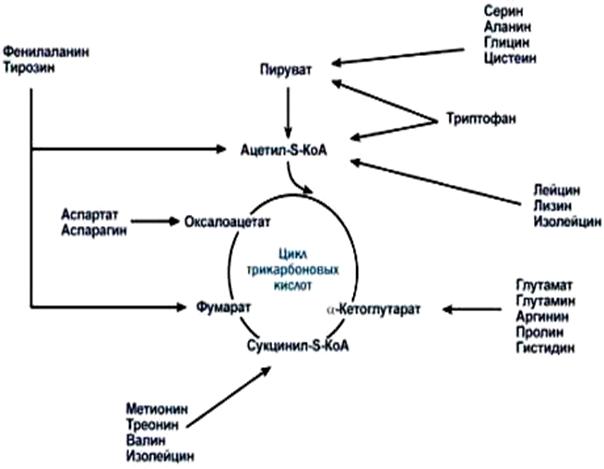 затем вступают в цикл трикарбоновых кислот и окисляются полностью.
затем вступают в цикл трикарбоновых кислот и окисляются полностью.
Рис. 21. Пути превращений аминокислот.
Углеродные скелеты 10 аминокислот расщепляются до ацетил-КоА. Причем, 5 из этих 10 аминокислот (аланин, цистеин, глицин, серин, треонин) расщепляются до ацетил-КоА через пируват. Другие 5 (фенилаланин, тирозин, лейцин, лизин, триптофан) – через ацетоацетил-КоА. Как известно, ацетоацетил-КоА является центральным продуктом в метаболизме кетоновых тел. В печени из этих аминокислот могут образовываться кетоновые тела и поэтому их называют кетогенными. Остальных – глюкогенными, т.к. из пирувата легко синтезируется глюкоза. Однако такое разделение аминокислот весьма условное, потому что, в целом всех аминокислот можно называть глюкогенными, тем более некоторые аминокислоты могут расщепляться, как с образованием пирувата, так и ацетоацетил-КоА.
Кроме ацетил-КоА, при катаболизме аминокислот могут образоваться α-кетоглутарат, сукцинил-КоА, фумарат и оксалоацетат (рис.21).
Универсальные процессы в катаболизме
аминокислот.
Каждая аминокислота подвергается распаду по индивидуальному механизму. Некоторые катаболические пути достаточно сложные, многоступенчатые (до 13 последовательных реакций), с образованием большого количества метаболитов, которые в свою очередь могут вовлекаться в различные биохимические процессы. Например, при расщеплении триптофана образуются продукты, которые могут служить предшественниками нейрогормона серотонина, никотиновой кислоты и др.
Известны ряд превращений, которые встречаются в способах расщепления всех аминокислот, т.е. они являются общими для всех катаболических путей. К ним относятся: дезаминирование, трансаминирование и декарбоксилирование. В биологии они больше известны, как универсальные механизмы расщепления аминокислот.
Дезаминирование – отщепление аминогрупп аминокислот. Доказано существование четырех типов дезаминирования. Во всех случаях NH2 группа аминокислот освобождается в виде NH3.
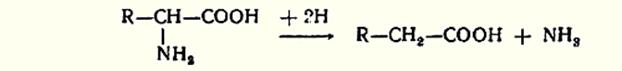 1. Восстановительное дезаминирование.
1. Восстановительное дезаминирование.
2. Гидролитическое дезаминирование.
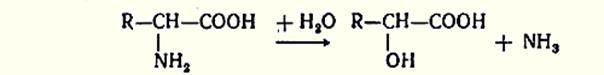
3. Внутримолекулярное дезаминирование.
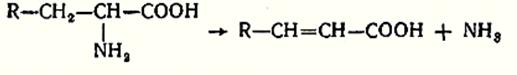
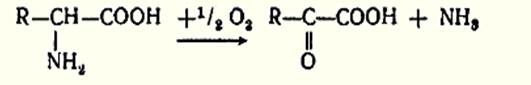 4. Окислительное дезаминирование.
4. Окислительное дезаминирование.
Преобладающим типом для животных тканей, растений и большинства аэробных микроорганизмов является окислительное дезаминирование аминокислот, протекающее в двух стадиях с образованием неустойчивого промежуточного продукта - иминокислоты. Однако нужно отметить, что большинство ферментов, катализирующие окислительное дезаминирование аминокислот, при физиологических значениях рН малоактивны. В животных тканях наиболее активным, является фермент, катализирующий окислительное дезаминирование глутаминовой кислоты - глутаматдегидрогеназа. Конечным продуктом реакции является α-кетоглутарат.
Трансаминирование (переаминирование) - реакции межмолекулярного переноса аминогруппы от аминокислоты на α-кетокислоту без промежуточного образования аммиака.
Реакции трансаминирования являются обратимыми и универсальными для всех живых организмов. Протекают при участии специфических ферментов - аминотрансфераз. В трансаминировании могут участвовать любая α-аминокислота и любая α-кетокислота с образованием новой амино- и кетокислоты. Учитывая тот факт, что в животных тканях с высокой скоростью подвергается окислительному дезаминированию глутаминовая кислота, можно предположить, что одним из основных субстратов для трансаминирования является α-кетогутарат. В настоящее время считается доказанным не только то, что практически все аминокислоты реагируют с α-кетоглутаровой кислотой с образованием глутаминовой кислоты и соответствующей кетокислоты, но и то, что реакции трансаминирования и окислительного дезаминирования сопряжены в едином процессе, который протекает по схеме:
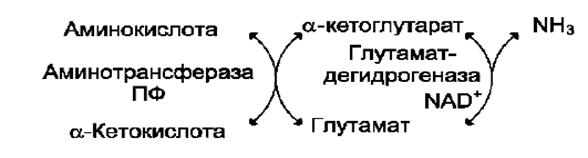
Рис. 22. Схема непрямого дезаминирования аминокислот
Поскольку все реакции данного процесса являются обратимыми, создаются условия для синтеза по существу любой аминокислоты, при наличии соответствующий α-кетокислоты.
Декарбоксилирование - отщепление карбоксильной группы аминокислот в виде углекислого газа. Реакция является необратимой и катализируется декарбоксилазами. Различают несколько видов декарбоксилирования, среди которых наибольшее распространение получило α-декарбоксилирование, т.е. отщепление –СООН группы у α-углерода аминокислоты. Продуктами декарбоксилирования являются СО2 и амины, а также могут быть диамины и новая аминокислота в зависимости от характера декарбоксилируемой аминокислоты.
Некоторые амины (триптамин, гистамин) обладают биологической активностью, среди диаминов известны ядовитые вещества (кадаверин, путресцин). Существуют специальные механизмы обезвреживания подобных соединений, суть которых в целом сводится к окислительному дезаминированию с выделением аммиака.
Способы обезвреживания аммиака.
Одним из конечных продуктов обмена аминокислот является высокотоксичное соединение - аммиак. Поэтому концентрация аммиака в организме должна сохраняться на низком уровне. Действительно, уровень аммиака в крови в норме не превышает 60 мкмоль/л (это почти в 100 раз меньше концентрации глюкозы в крови). В организме человека подвергается распаду около 100 г аминокислот в сутки, следовательно, высвобождается около 15 г аммиака. В опытах на кроликах показано, что концентрация аммиака 3 ммоль/л является летальной. Таким образом, аммиак должен подвергаться постоянному обезвреживанию с образованием нетоксичных соединений, легко выделяющихся с мочой.
Можно выделить несколько основных способов обезвреживания аммиака.
- образование амидов дикарбоновых аминокислот (восстановительное аминирование);
- синтез мочевины;
- образование аммонийных солей;
1. Восстановительное аминирование.
Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах - это биосинтез амидов глутаминовой и аспарагиновой кислот (глутамина или аспарагина).
Образование глутамина (аспарагина) является, во-первых, экспресс способом нейтрализации аммиака и во-вторых, способом переноса аммиака от периферических тканей к печени и почкам, где происходит окончательное обезвреживание этого яда и выведение из организма.
Обезвреживание аммиака путем синтеза глутами-на имеет и анаболическое значение, поскольку глутамин используется для синтеза ряда соединений. Амидная группа глутамина может использоваться для синтеза аспарагина, глюкозамина и других аминосахаров, пуриновых и пиримидиновых нуклеотидов. Таким образом, в этих реакциях азот аммиака включается в разнообразные структурно-функциональные компоненты клетки.
2. Образование аммонийных солей.
В целом, весь аммиак из организма удаляется с мочой двумя путями:
- в виде мочевины, которая синтезируется в печени;
- в виде солей аммония образующихся в эпителии канальцев почек;
Экскреция аммиака с мочой в норме невелика — около 0,5 г в сутки. Но она в несколько раз повышается при ацидозе.
Синтез аммонийных солей происходит в просвете канальцев почек из секретируемых сюда аммиака и фильтрующихся анионов первичной мочи.
Аммиак в почках образуется также за счет амидной группы глутамина крови, который не задерживается в печени. Глутамин гидролизуется глутаминазой, имеющейся в клетках эпителия канальцев почки
Образование солей аммония в почечных канальцах является важным механизмом регуляции кислотно-основного состояния организма. Оно резко возрастает при метаболическом ацидозе - накоплении в организме кислот и снижается при потере кислот организмом (алкалозе).
3. Основным механизмом обезвреживания аммиака в организме является синтез мочевины. Мочевина выводится из организма с мочой в качестве главного конечного продукта белкового обмена. На долю мочевины приходится до 80-85 % от всего выводимого из организма азота. Основным местом синтеза мочевины является печень. Синтез мочевины является циклическим метаболическим процессом и носит название орнитинового цикла мочевинообразования Кребса.
Орнитиновый цикл тесно связан с циклом трикарбоновых кислот (бицикл Кребса). Механизм процесса достаточно простой, рассматривается всего лишь в трех стадиях. Однако особенностью цикла является то, что ферменты реакций распределены между цитоплазмой и митохондрией клеток.
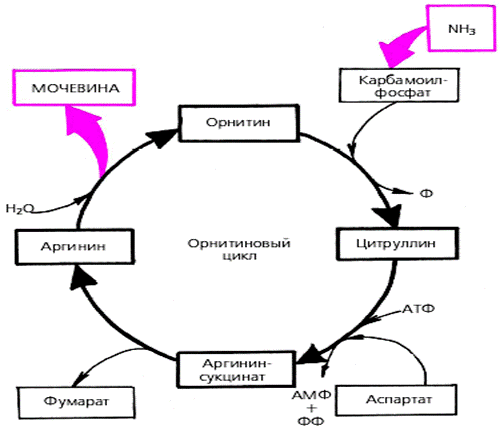 За каждый оборот цикла из двух молекул аммиака синтезируется одна молекула мочевины, и расходуются три молекулы АТФ.
За каждый оборот цикла из двух молекул аммиака синтезируется одна молекула мочевины, и расходуются три молекулы АТФ.
Рис. 23. Схема биосинтеза мочевины.
Биосинтез белка
Синтез белка непрерывно происходит в каждой живой клетке. Белоксинтезирующая система клетки предполагает координированного взаимодействия более 300 различных макромолекул и включает набор всех 20 аминокислот, входящих в состав белковых молекул; минимум 20 разных тРНК; набор минимум 20 различных ферментов – аминоацил-тРНК-синтетаз; рибосомы; белковые факторы, участвующие в синтезе на разных уровнях трансляции; иРНК в качестве главного компонента системы, несущей информацию о структуре белка, синтезирующегося в рибосоме.
Несмотря на такую сложность белки в клетке синтезируются достаточно высокой скоростью. Например, в клетках E.coli, белок, состоящий из 100 аминокислот, синтезируется за 5 сек.
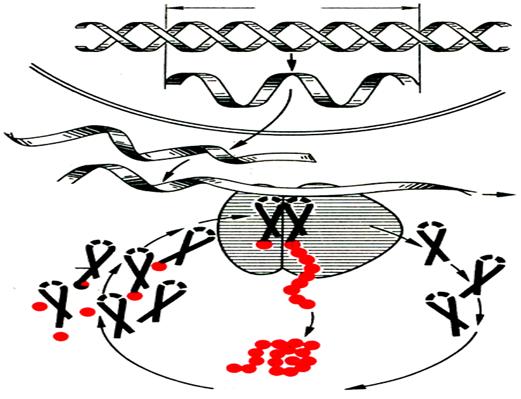
Рис. 24. Принципиальная схема биосинтеза белка (по А.С. Спирину). Кружочки – свободные аминокислоты и их остатки в составе полипептидной цепи.
Аминокислотная последовательность белка (первичная структура), как известно, закодирована в генах. Матричная РНК (мРНК) или информационная РНК (иРНК) служит для переноса генетической информации от ДНК в ядре до цитоплазмы, где она соединяется с рибосомами и служит матрицей, на которой осуществляется синтез белка. Процесс синтеза информационного РНК называется транскрипция. После того как стало известно особенности строения гена был полностью расшифрован механизм транскрипции. Предварительно синтезируется полная комплиментарная копия гена – pro-и РНК, котрая претерпевает затем процесс созревания (процессинг иРНК).
Процессинг состоит в ферментативном разрезании первичного транскрипта с последующим удалением его интронных участков и воссоединением (сплайсингом) экзонных участков, формирующих непрерывную кодирующую последовательность зрелой мРНК, которая в дальнейшем участвует в трансляции генетической информации. Во время процессинга происходит также модификация 5'-и 3'-концов формирующейся зрелой молекулы мРНК.
Трансляция как очередной этап реализации генетической информации заключается в синтезе полипептида на рибосоме, при котором в качестве матрицы используется молекула мРНК.
Трансляцию можно представить как процесс перевода «нуклеотидного языка» иРНК на «аминокислотный» полипептидной цепи молекулы белка. Происходит данный процесс благодаря тому, что в нуклеотидной последовательности мРНК имеются кодовые «слова» для каждой аминокислоты – генетический код. Каждое последовательное тройное сочетание нуклеотидов кодирует одну аминокислоту – кодон. Генетический код состоит из 64 кодонов.
Генетический код является вырожденным. Это означает, что большинство аминокислот кодируется несколькими кодонами. Последовательность первых двух нуклеотидов определяет специфичность каждого кодона, т.е. кодоны кодирующие одну и ту же аминокислоту различаются только третьими нуклеотидами.
Другой отличительной особенностью генетического кода является его непрерывность, отсутствие «знаков препинания», т.е. сигналов, указывающих на конец одного кодона и начало другого. Другими словами, код является линейным, однонаправленным и непрерывающимся. Наиболее существенной особенностью кода является его универсальность для всех живых организмов от бактерий до человека. Код не подвергся существенным изменениям за миллионы лет эволюции.
Среди 64 кодонов 3, а именно УАГ, УАА, УГА, оказываются «бессмысленными». Эти кодоны выполняют важную функцию сигналов терминации в синтезе полипептида в рибосомах.
Процесс трансляции можно условно подразделить на три основные стадии — инициацию, элонгацию и терминацию.
Инициация трансляции обеспечивается соединением молекулы мРНК с определенной областью малой субъединицы диссоциированной рибосомы и формированием инициирующего комплекса.
Процесс элонгации непосредственно связан с большой субъединицей рибосом, которая имеет специфические участки – А (аминокислотный) и Р (пептидильный). Начинается с образования пептидной связи между инициирующей (первой в цепочке) и последующей (второй) аминокислотами. Затем происходит перемещение рибосомы на один триплет мРНК в направлении 5'→ 3', что сопровождается отсоединением инициирующей тРНК от матрицы (мРНК), от инициирующей аминокислоты и выходом ее в цитоплазму. При этом вторая по счету аминоацил-тРНК передвигается из A-участка в Р-участок, а освободившийся А -участок занимается следующей (третьей по счету) аминоацил-тРНК. Процесс последовательного передвижения рибосомы «триплетными шагами» по нити мРНК повторяется, сопровождаясь освобождением тРНК, поступающих в Р-участок, и наращиванием аминокислотной последовательности синтезируемого полипептида.
Терминация трансляции связана с вхождением одного из трех известных стоп-триплетов мРНК в А-участок рибосомы. Поскольку такой триплет не несет информации о какой-либо аминокислоте, но узнается соответствующими белками терминации, то процесс синтеза полипептида прекращается и он отсоединяется от матрицы (мРНК).
Посттрансляционная модификация полипептида представляет собой завершающий этап реализации генетической информации в клетке, приводящий к превращению синтезированного полипептида в функционально активную молекулу белка. При этом первичный полипептид может претерпевать процессинг, состоящий в ферментативном удалении инициирующих аминокислот, отщеплении других (ненужных) аминокислотных остатков и формирование уровней структурной организации и др.
Поможем написать любую работу на аналогичную тему

